
【题目】NH3可用于制造硝酸、纯碱等,还可用于烟气脱硝。
(1)NH3催化氧化可制备硝酸。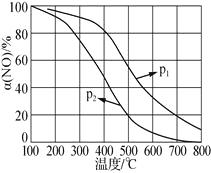
①NH3氧化时发生如下反应:
4NH3(g)+5O2(g)===4NO(g)+6H2O(g) ΔH1=-907.28 kJ·mol-1
4NH3(g)+3O2(g)===2N2(g)+6H2O(g) ΔH2=-1269.02 kJ·mol-1
则4NH3(g)+6NO(g)===5N2(g)+6H2O(g) ΔH3。
②NO被O2氧化为NO2。其他条件不变时,NO的转化率[α(NO)]与温度、压强的关系如上图所示。则p1p2(填“>”“<”或“=”);温度高于800℃时,α(NO)几乎为0的原因是。
(2)利用反应NO2+NH2―→N2+H2O(未配平)消除NO2的简易装置如下图所示。电极b的电极反应式为;消耗标准状况下4.48 L NH3时,被消除的NO2的物质的量为mol。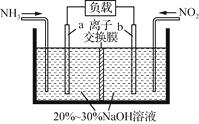
(3)合成氨的原料气需脱硫处理。一种脱硫方法是:先用Na2CO3溶液吸收H2S生成NaHS;NaHS再与NaVO3反应生成S、Na2V4O9和物质X。NaHS与NaVO3反应的化学方程式为。
【答案】
(1)-1811.63 kJ·mol-1;>;NO2几乎完全分解
(2)2NO2+8e-+4H2O=8OH-+N2;0.15
(3)2NaHS+4NaVO3+H2O=Na2V4O9+2S↓+4NaOH
【解析】解:(1)①4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H1=-907.28kJmol-1;②4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H2=-1 269.02kJmol-1;
目标反应的反应热为:![]() =1811.63 kJmol-1 ,
=1811.63 kJmol-1 ,
所以答案是:-1811.63 kJmol-1;
②温度相同时p1的一氧化氮的氮率大,所以增大压强平衡正向移动,所以p1>p2;α(NO)几乎为0的原因是无二氧化氮,NO2几乎完全分解;所以答案是:>;NO2几乎完全分解;
(2)(2)联合制碱工艺示意图如图2所示,“碳化”时发生反应的化学方程式为CO2+NH3+H2O+NaCl═NaHCO3↓+NH4C1,所以答案是:CO2+NH3+H2O+NaCl═NaHCO3↓+NH4C1;
(3)电极b的电极发生还原反应,二氧化氮转化生成氮气,电极反应式为2NO2+8e-+4H2O═8OH-+N2;标准状况下4.48L NH3的物质的量为:0.2mol,根据4NH3~3NO2 , 所以被消除的NO2的物质的量为![]() ×0.2=0.15mol,所以答案是:2NO2+8e-+4H2O═8OH-+N2;0.15;
×0.2=0.15mol,所以答案是:2NO2+8e-+4H2O═8OH-+N2;0.15;
(4)NaHS再与NaVO3反应生浅黄色沉淀是硫单质和Na2V4O9 , 根据得失电子守恒,得化学方程式为:2NaHS+4NaVO3+H2O═Na2V4O9+2S↓+4NaOH,所以答案是:2NaHS+4NaVO3+H2O═Na2V4O9+2S↓+4NaOH.
【考点精析】解答此题的关键在于理解反应热和焓变的相关知识,掌握在化学反应中放出或吸收的热量,通常叫反应热,以及对化学平衡的计算的理解,了解反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


科目:高中化学 来源: 题型:
【题目】乙酸丁酯是重要的化工原料,具有水果香味。实验室制备乙酸丁酯的反应、装置示意图
和有关信息如下: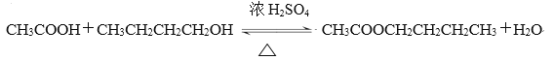
乙酸 | 正丁醇 | 乙酸丁酯 | |
熔点/℃ | 16.6 | -89.5 | -73.5 |
沸点/℃ | 117.9 | 117 | 126.0 |
密度/g·cm-3 | 1.1 | 0.80 | 0.88 |

(1)乙酸丁酯粗产品的制备
在干燥的50 mL圆底烧瓶中,装入沸石,加入12.0 mL正丁醇和16.0 mL冰醋酸(过量),再加3~4滴浓硫酸。然后再安装分水器(作用:实验过程中不断分离除去反应生成的水)、冷凝管,然后小火加热。将烧瓶中反应后的混合物冷却与分水器的酯层合并。装置中冷水应从(填“a”或“b”)口通入;通过分水器不断分离除去反应生成的水的目的是。
(2)乙酸丁酯的精制
将乙酸丁酯粗产品用如下的操作进行精制:①水洗、②蒸馏、③用无水MgSO4干燥、④用10%碳酸钠洗涤。
①正确的操作步骤是(填标号)。
A.①②③④ B.③①④② C.④①③② D.③④①②
②在乙酸丁酯的精制中,用10%碳酸钠洗涤的主要目是。
③在洗涤、分液操作中,应充分振荡,然后静置,待分层后(填标号)。
a.直接将乙酸丁酯从分液漏斗的上口倒出
b.直接将乙酸丁酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸丁酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸丁酯从上口倒出
(3)计算产率
测量分水器内由乙酸与丁醇反应生成的水体积为1.8 mL,假设在制取乙酸丁酯过程中反应
物和生成物没有损失,且忽略副反应,乙酸丁酯的产率为。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯苯是重要的有机化工产品,是染料、医药、有机合成的中间体,工业上常用“间歇法”制取。反应原理、实验装置图(加热装置都已略去)如下: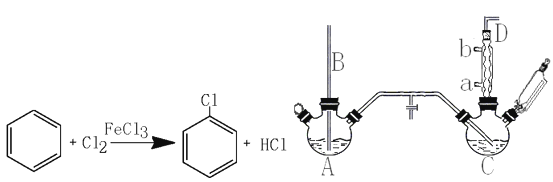
已知:氯苯为无色液体,沸点132.2℃,常温下不与氢氧化钠溶液反应。
回答下列问题:
(1)A反应器是利用实验室法制取氯气,中空玻璃管B的作用是。冷凝管中冷水应从(填“a”或“b”)处通入。
(2)把干燥的氯气通入装有干燥苯的反应器C中(内有相当于苯量1%的铁屑作催化剂),加热维持反应温度在40~60℃为宜,温度过高会生成二氯苯。
①对C加热的方法是(填序号)。
a.酒精灯加热 b.酒精喷灯加热 c.水浴加热
②D出口的气体成分有HCl、和。
(3)C反应器反应完成后,工业上要进行水洗、碱洗及食盐干燥,才能蒸馏。碱洗之前要水洗的目的是洗去部分无机物,同时减少碱的用量,节约成本。写出用10%氢氧化钠碱洗时可能发生的化学反应方程式:;(写两个即可)。
(4)上述装置图中A、C反应器之间,需要增添一个U形管,其内置物质是。
(5)工业生产中苯的流失情况如下:
项目 | 二氯苯 | 尾气 | 不确定苯耗 | 流失总量 |
苯流失量(kg/t) | 13 | 24.9 | 51.3 | 89.2 |
则1t苯可制得成品为t(只要求列式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+F2(g)=2HF(g)△H=﹣270kJ/mol,下列说法正确的是( )
A.在相同条件下,1mol H2与1mol F2的能量总和大于2mol HF气体的能量
B.1mol H2与1mol F2反应生成2mol液态HF放出的热量小于270kJ
C.该反应的逆反应是放热反应
D.该反应过程的能量变化可用如图来表示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,满足下如图物质一步转化关系的选项是( )
X | Y | Z | |
A | Na | NaOH | NaHCO3 |
B | Cu | CuSO4 | Cu(OH)2 |
C | C | CO | CO2 |
D | Si | SiO2 | H2SiO3 |

A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两位学生想利用原电池反应检测金属的活动性顺序,两人均使用镁片与铝片作电极,但甲同学将电极放入6molL﹣1H2SO4溶液中,乙同学将电极放入6molL﹣1的NaOH溶液中,如图所示. 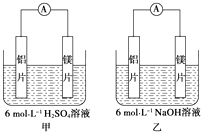
(1)如果甲、乙同学均认为若构成原电池的电极材料都是金属,则构成负极材料的金属应比构成正极材料的金属活泼,则甲会判断出的活动性更强,而乙会判断出的活动性更强(填元素符号).
(2)由此实验,可得到哪些正确的结论?(填字母).
A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动性顺序表已过时,已没有实用价值
D.该实验说明化学研究的对象复杂,反应受条件影响较大,因此应具体问题具体分析
(3)上述实验也反过来证明了“直接利用金属活动性顺序表判断原电池的正、负极”的做法(填“可靠”或“不可靠”).如不可靠,请你提出另一个判断原电池正、负极的可行的实验方案(如可靠,此空可不填)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com