
下列有关物质的性质及应用均正确的是( )
A.常温下浓硫酸能使铝发生钝化,可在常温下用铝制容器贮藏贮运浓硫酸
B.氢氧化铁胶体具有很强的吸附性,可用于除去水中的所有杂质
C.二氧化氯具有还原性,可用于自来水的杀菌消毒
D.铜的金属活泼性比铁的差,可在海轮外壳上装若干铜块以减缓其腐蚀
科目:高中化学 来源: 题型:
下列有关化学反应速率的说法中,正确的是
A.往容积一定的容器中再通入O2,可以加快反应2SO2+O2 2SO3的反应速率
2SO3的反应速率
B.用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快产生氢气的速率
C.对于C(s)+H2O(g)  CO(g)+H2(g)的反应,加入固体炭,反应速率加快
CO(g)+H2(g)的反应,加入固体炭,反应速率加快
D.100 mL 2 mol·L-1的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
根据X、Y、Z、W四种常见元素的下列信息,回答有关问题:
信息1 上述四种元素电子层数≤3,原子序数依次增大,且原子核外最外层电子数均不少于2。
(1)根据信息1 ,X一定不是________(填序号)。
,X一定不是________(填序号)。
A.氢 B.碳 C.氧 D.硫
信息2 上述四种元素的单质均能在足量的氧气中燃烧,生成的四种氧化物中,有两种能溶于稀硫酸,三种能溶于浓氢氧化钠溶液,氧化物的相对分子质量都大于26。
(2)这四种元素中是否有一种是铝元素______ __(填“是”或“否”)。
__(填“是”或“否”)。
信息3 向上述四种元素的单质组成的混合物中加入过量稀盐酸,固体部分溶解,过滤,向滤液中加入过量的烧碱溶液,最终溶液中析出白色沉淀。
(3)生成的白色沉淀物的化学式为________。
信息4 向上述四种元素的单质组成的混合物中加入足量烧碱溶液,固体部分溶解,过滤,向滤液中加入足量的稀盐酸,最终溶液中析出白色沉淀。
(4)生成的白色沉淀物的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某种兴奋剂的结构简式如图所示,下列说法正确的是 ( )

A.该分子中的所有碳原子一定在同一个平面上
B.滴入酸性KMnO4溶液,观察紫色褪去,能证明结构中存在碳碳双键
C.遇FeCl3溶液呈紫色,因为该物质与苯酚属于同系物
D.1mol该物质分别与浓溴水、H2反应,最多消耗Br2和H2的物质的量分别为4mol、7mol
查看答案和解析>>
科目:高中化学 来源: 题型:
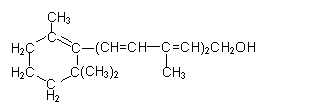 (1)维生素A对人体特别是对人的视力有重要作用,其结构简式如下:
(1)维生素A对人体特别是对人的视力有重要作用,其结构简式如下:
(1)1mol该化合物可与 molBr2发生加成反应。
(2)写出用键线式表示的有机物的分子式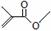 分子式:
分子式:
(3)烯烃A是2-丁烯的一种同分异构体,它在催化剂作用下与氢气反应的产物不是正丁烷,则A的结构简式为 ;
(4)写出由苯丙烯( 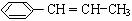 )在催化剂作用下生成聚苯丙烯的反应方程式:
)在催化剂作用下生成聚苯丙烯的反应方程式:
(5)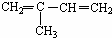 与Br2以物质的量之比为1:1反应,所得产物有
与Br2以物质的量之比为1:1反应,所得产物有
种(不考虑顺反异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
(13分)二氧化锰可用作干电池去极剂,合成工业的催化剂和氧化剂,玻璃工业和搪瓷工业的着色剂、消色剂、脱铁剂等。
(1)二氧化锰在酸性介质中是一种强氧化剂,请用化学方程式证明:______________________。
(2)锌—锰碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。电池的总反应式为Zn(s)+2MnO2(s)+H2O(l)===Zn(OH)2(s)+Mn2O3(s)。
①电池工作时,MnO2发生________反应。
②电池的正极反应式为________。
(3)工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下:

已知:软锰矿的主要成分为MnO2,还含Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物,部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表。
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 |
| 沉淀物 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 8.0 | -0.42 | 2.5 | 7 | 7 |
回答下列问题:
①硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为________________________。
②试剂X为________。
③滤渣A的主要成分为________。
④加入MnS的目的主要是除去溶液中的________。
查看答案和解析>>
科目:高中化学 来源: 题型:
与Na、Na2O、Na2O2、NaOH、Na2CO3、NaHCO3六种物质都能发生反应的是( )
A.H2O B.CO2
C.H2SO4 D.Ca(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
在实验室中保存下列药品的方法,正确的是 ( )
A.氢氟酸可以用玻璃试剂瓶保存
B.浓硫酸盛放在广口瓶中
C.在同一层药品橱里存入浓氨水和浓盐酸
D.盛放硅酸钠水溶液的试剂瓶应用橡皮塞
查看答案和解析>>
科目:高中化学 来源: 题型:
汽车尾气(含烃类、CO、NO与SO2等)是城市主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它使NO与CO反应生成可参与大气生态循环的无毒气体,反应原理:2NO(g)+2CO(g) N2(g)+2CO2(g),在298 K、100 kPa下,ΔH=-113 kJ/mol,ΔS=-145 J/(mol·K)。
N2(g)+2CO2(g),在298 K、100 kPa下,ΔH=-113 kJ/mol,ΔS=-145 J/(mol·K)。
(1)为了提高该反应的速率和NO的转化率,采取的正确措施为 。
A.加催化剂同时升高温度 B.加催化剂同时增大压强
C.升高温度同时充入N2 D.降低温度同时增大压强
(2)该反应达到平衡时若增大压强,则混合气体的平均相对分子质量________,若升高温度,则该反应的平衡常数________(均填“增大”、“减小”或“不变”)。
(3)在如图中画出在t1 、t2时刻条件改变后的图象(其他条件不变)。
t1:增大NO的浓度 t2:降低温度
(4)通过计算判断该条件下反应能否自发进行。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com