
科目:高中化学 来源:2014-2015陕西省宝鸡市高一4月月考化学试卷(解析版) 题型:选择题
现有下列短周期元素性质的数据:下列关于表中11种元素的说法正确的是
元素 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |
原子半径(10-10m) | - | 0.37 | 0.74 | 0.75 | 0.77 | 0.82 | 0.99 | 1.10 | 1.52 | 1.60 | 1.86 |
最高或最低化合价 | 0 | +1 | +5 | +4 | +3 | +7 | +5 | +1 | +2 | +1 | |
-2 | -3 | -4 | -1 | -3 |
A.上表中11种元素中形成的非金属单质都有非极性共价键
B.②⑨处于同一周期,④⑧处于同一主族
C.上表中11种元素中最高价氧化物对应的水化物中⑦号酸性最强
D.⑥原子结构示意图为: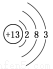
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省天水市高三下学期二模考试理综化学试卷(解析版) 题型:实验题
(14分)铝热反应是铝的一个重要性质。某校化学兴趣小组同学,取磁性氧化铁在如图实验装置进行铝热反应,冷却后得到“铁块”混合物。

(1)取反应后的“铁块”研碎取样称量,加入如图装置滴入足量NaOH溶液充分反应,测量生成气体体积。试回答下列问题:
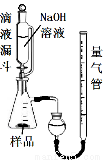
①该实验的实验目的是:测量样品中 的百分含量(填物质名称)。
②量气管的量具部分是一个中学实验常见量具改装而成,该仪器的名称为 。
③量气管在读数时调节左右管液面相平之前的步骤是________ _。
④装置中使用带平衡管的滴液漏斗代替普通分液漏斗,除了可以平衡压强让液体顺利滴入锥形瓶之外还可以起到降低实验误差的作用。如果装置使用分液漏斗,测量出的该物质百分含量将会 (填“偏大”或“偏小”)。
(2)另称取“铁块”样品溶于盐酸,向其中滴加KSCN溶液,溶液没有出现血红色。为测定该实验所得 “铁块”的成分,实验流程如图所示。

几种氢氧化物开始沉淀和完全沉淀的pH如下表所示。
Fe2+ | Fe3+ | Al3+ | Mg2+ | |
开始沉淀时的pH | 7.5 | 2.8 | 4.2 | 9.6 |
沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
①试剂A应选择 ,试剂B应选择 。(填序号)
A.稀盐酸
B.氧化铁
C.H2O2溶液
D.氨水
E.MgCO3固体
②灼烧完全的标志是 。
③若最终红色粉未M的质量为12.0 g,则该“铁块”中铁的百分含量是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市西城区高三二模理综化学试卷(解析版) 题型:选择题
化学与生产、生活密切相关。下列叙述正确的是
A.煤的干馏和煤的液化均是物理变化
B.海水淡化的方法有蒸馏法、电渗析法等
C.天然纤维和合成纤维的主要成分都是纤维素
D.用活性炭为糖浆脱色和用次氯酸盐漂白纸浆的原理相同
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市海淀区高三第二学期期末练习理综化学试卷(解析版) 题型:选择题
下图装置用于气体的干燥、收集和尾气吸收,其中X、Y、Z对应都正确的是
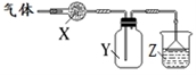
X | Y | Z | |
A | 无水硫酸铜 | 氯气 | 饱和食盐水 |
B | 碱石灰 | 氨气 | 水 |
C | 氯化钙 | 二氧化硫 | 氢氧化钠 |
D | 氯化钙 | 一氧化氮 | 氢氧化钠 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市海淀区高三4月模拟练习化学试卷(解析版) 题型:选择题
元素周期表中ⅣA元素包括C、Si、Ge、Sn、Pb等,已知Sn的+4价稳定,而Pb的+2价稳定。结合所学知识,判断下列反应中(反应条件略)正确的是
①Pb+2Cl2 PbCl4 ②Sn+2Cl2
PbCl4 ②Sn+2Cl2 SnCl4 ③SnCl2+Cl2
SnCl4 ③SnCl2+Cl2 SnCl4
SnCl4
④PbO2+4HCl PbCl4+2H2O ⑤Pb3O4+8HCl
PbCl4+2H2O ⑤Pb3O4+8HCl 3PbCl2+Cl2↑+4H2O
3PbCl2+Cl2↑+4H2O
A.②③⑤ B.②③④ C.①②③ D.①②④⑤
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市丰台区高三第二次模拟理综化学试卷(解析版) 题型:实验题
(14分)硫是一种生命元素,组成某些蛋白质时离不开它。SO2是硫的一种重要氧化物,为探究SO2的性质,某化学兴趣小组的同学设计了如下系列实验:
(1)为验证SO2具有还原性。将SO2气体通入溴水中,溴水褪色。写出反应的化学方程式 。
(2)已知SO2与Na2O2的反应为进一步探究Na2O2与SO2的反应,用如图所示装置进行实验。
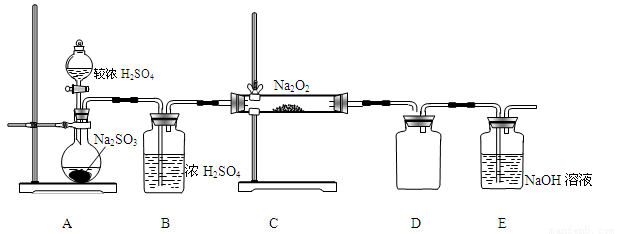
①写出A中反应的化学方程式 。
②B装置的作用是 。
③在F处检验到有O2生成,据此甲同学认为Na2O2与SO2发生了反应,反应的化学方程式为 。
④乙同学认为Na2O2与SO2反应除生成Na2SO3和O2外,还有Na2SO4生成,为检验是否有Na2SO4生成,他们设计了如下实验方案。
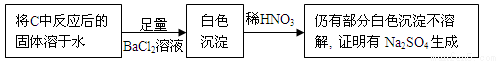
上述方案 (“合理”或“不合理”),简要说明理由 。
⑤E装置中溶液呈碱性,为检验吸收液中其他阴离子,完成下列实验方案。
实验步骤 | 实验现象 | 实验结论 |
取少量吸收液于试管中滴加BaCl2溶液至过量 | 白色浑浊 | |
固体部分溶解,产生气泡 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市五校高三第二学期联考化学试卷(解析版) 题型:填空题
(本题12分)
磷是重要的非金属元素。磷单质及其化合物在工业生产中有着广泛的应用。
次磷酸钠(NaH2PO2)可用于化学镀镍等等。
完成下列填空
(1).磷原子的最外层电子排布的轨道表示式为 ______ ;氧原子核外电子云有 种不同的伸展方向,其最外层有 种不同运动状态的电子。NaH2PO2中涉及到四种元素,它们的原子半径由小到大的顺序为 。
(2).写出与磷同周期的主族元素中,离子半径最小的元素,其最高价氧化物对应水化物的电离方程式 。
(3).磷酸二氢钠主要用于制革、处理锅炉水及在食品工业、发酵工业中作缓冲剂。其水溶液呈酸性的原因是__________________________________________________。(请用文字描述)
已知Ca3(PO4)2与SiO2、C高温共热可以反应得到CaSiO3、P4蒸气和CO。
(4).写出该反应的化学方程式__________________________。
(5).每消耗24.0g碳时,有 mol电子发生转移。反应所得混合气体,折算成标况下,其气体密度为 g/L。
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省高二4月月考化学试卷(解析版) 题型:选择题
某有机物链状分子中含a个甲基,n个亚甲基(—CH2—),m个次甲基(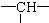 ),其余为羟基。则羟基的个数为
),其余为羟基。则羟基的个数为
A.m+2-a B.m-a C.2n+3m-a D.m+2n+2-a
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com