
一定能在下列溶液中大量共存的离子组是 ( )
A.含有大量Al3+的溶液:Na+、NH4+、SO42-、Cl-
B.碱性溶液:Na+、Ca2+、SO42-、CO32-
C.含有大量Fe3+的溶液:Na+、Mg2+、NO3-、SCN-
D.含有大量NO3-的溶液:H+、Fe2+、SO42-、Cl-
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案科目:高中化学 来源:2016-2017学年黑龙江佳木斯一中高一上月考二化学卷(解析版) 题型:选择题
“嫦娥二号”探月卫星于2010年10月1日18时59分在西昌卫星发射中心发射升空,并获得了圆满成功。据悉,发射“嫦娥二号”探月卫星发射任务的长征三号丙运载火箭使用胼为燃料。已知胼的化学式为N2H4,若1g胼中含有的原子总数为a,则阿伏伽德罗常数NA的数值可表示为
A.16a/3 B.a C.32a D.a/32
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上学期第二次月考化学试卷(解析版) 题型:推断题
四种短周期元素W、X、Y、Z,原子序数依次增大,请结合表中信息回答下列问题。
| W | X | Y | Z |
结构 | 最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物 | 焰色反应呈黄色 | 在同周期主族元 | 最高正价与最 |
(1)Z在元素周期表中位于 族。
(2)上述元素的最高价氧化物对应的四种水化物中,有一种物质在一定条件下均能与其它三种物质发生化学反应,该元素是 (填元素符号)。
(3)①下列可作为比较X和Y金属性强弱的依据是 (填序号)。
A.自然界中的含量 B.相应氯化物水溶液的pH
C.单质与水反应的难易程度 D.单质与酸反应时失去的电子数
②W、X、Y的离子半径由大到小的顺序为 。(填对应的离子符号)
(4)W的一种氢化物HW3可用于有机合成,其酸性与醋酸相似。体积和浓度均相等的HW3与X的最高价氧化物对应的水化物混合,反应的化学方程式是 ,混合后溶液中离子浓度由大到小的顺序是 。
(5)Y单质和Mg组成的混合物是一种焰火原料,某兴趣小组设计如下所示的实验方案,测定混合物中Y的质量分数。
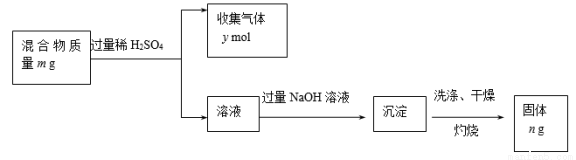
能确定混合物中Y的质量分数的数据有 (填序号)。
A.m、n B.m、y C.n、y
查看答案和解析>>
科目:高中化学 来源:2016-2017陕西西安长安区一中重点班高一12月考化学卷(解析版) 题型:实验题
某铝合金中含有铁、铝、镁、铜、硅。为了测定该合金中铝的含量,现设计了如下实验:

已知:Si+2NaOH+ H2O =Na2Si O3+2
O3+2 H2↑,H2SiO3是不溶于水的弱酸。
H2↑,H2SiO3是不溶于水的弱酸。
(1)固体A的成分是:____________,溶液M中的阴离子有:____________________
(2)步骤①②③中,过滤时玻璃棒的作用是 ,步骤④中,用到的仪器有三脚架、酒精灯以及
(3)步骤③中生成沉淀的离子方程式为:____________________________
(4)在空气中将NaOH溶液滴入FeCl2溶液中,观察到的现象是 ,反应的化学方程式是
(5)该样品中铝的质 量分数是:_____________________(用a、b表示)。
量分数是:_____________________(用a、b表示)。
(6)第④步中的沉淀需用蒸馏水洗涤,若未洗涤会使测定结果___________(填偏大或偏小)。
查看答案和解析>>
科目:高中化学 来源:2016-2017陕西西安长安区一中重点班高一12月考化学卷(解析版) 题型:选择题
下列实验能达到目的的是 ( )
A.用AlCl3溶液和氢氧化钠溶液反应制备Al(OH)3
B.把饱和FeCl3溶液滴加到氢氧化钠溶液中制备Fe(OH)3 胶体
C.若Fe2O3中含少量Al2O3,先加入过量氢氧 化钠溶液,然后过滤除去
化钠溶液,然后过滤除去
D.向某溶液中先加新制氯水,再加硫氰化钾溶液,溶液变红,证明原溶液中有Fe2+
查看答案和解析>>
科目:高中化学 来源:2016-2017陕西西安长安区一中重点班高一12月考化学卷(解析版) 题型:选择题
下列除杂的方法正确是( )
A.除去CO2中的少量HCl:通入NaOH溶液,收集气体
B.除去H2中的少量HCl:通入Na2CO3溶液,收集气体
C.除去NaCl溶液中少量CaCl2:加入过量Na2CO3溶液,过滤
D.除去BaSO4中少量BaCO3:加入过量稀盐酸,过滤
查看答案和解析>>
科目:高中化学 来源:2016-2017陕西西安长安区一中实验班高一12月考化学卷(解析版) 题型:推断题
氢能源是一种重要的清洁能源。现有两种可产生H2的化合物甲和乙。将 6.00 g 甲加热至完全分解,只得到一种常见金属单质和 6.72 L 的 H2(已折算成标准状况)。甲与水反应也能放出H2,同时还产生一种白色沉淀物,该白色沉淀既可以溶于盐酸,也可溶于 NaOH 溶液。化合物乙在催化剂存在下可分解得到H2 和另一种单质气体丙,丙在标准状况下的密度为1.25 g·L-1。请回答下列问题:
(1)甲是_______________;乙是______________。( 填化学式)
(2)甲与水反应的化学方程式是____________。
(3)气体丙的分子式是____________。
(4)乙在加热条件下可与 CuO 发生反应,生成红色固体和气体丙,写出该反应的化学方程式________________。
(5)有人提出产物Cu中可能还混有Cu2O,请设计实验方案验证:__________________。
(已知:Cu2O+2H+=Cu+Cu2++H2O;Cu、Cu2O 均可以溶解在 HNO3 溶液中)
(6)甲与乙之间_____________ (填“可能”或“不可能”)发生反应产生H2,判断理由是_______________。
查看答案和解析>>
科目:高中化学 来源:2016-2017陕西西安长安区一中实验班高一12月考化学卷(解析版) 题型:选择题
将0.4gNaOH 和 1.06g Na2CO3混合并配成溶液, 向溶液中滴加 0.1mol·L-1稀盐酸。 下列图像能正确表示加入盐酸的体积和生成 CO2的物质的量的关系的是( )
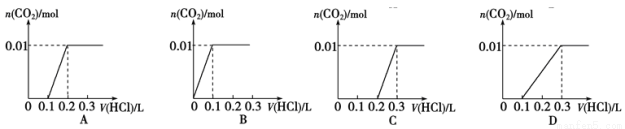
查看答案和解析>>
科目:高中化学 来源:2017届安徽马鞍山二中安师大附中高三12月联考化学卷(解析版) 题型:实验题
用铝土矿(含30% SiO2、40.8% Al2O3和少量Fe2O3等)制取铝硅合金材料有湿法、干法等方法,其中干法制备的工艺流程如下:
(1)若湿法处理铝土矿,用强酸浸取时,所得溶液中阳离子有 。
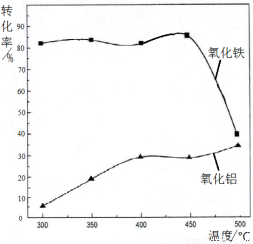
(2)焙烧除铁反应:4(NH4)2SO4 + Fe2O3  2NH4Fe(SO4)2 + 3H2O + 6NH3↑(Al2O3部分发生类似反应)。氧化物转化为硫酸盐的百分率与温度的关系如图,最适宜焙烧温度为 ,用电子式表示气体I的形成过程 。
2NH4Fe(SO4)2 + 3H2O + 6NH3↑(Al2O3部分发生类似反应)。氧化物转化为硫酸盐的百分率与温度的关系如图,最适宜焙烧温度为 ,用电子式表示气体I的形成过程 。
(3)操作①包括:加水溶解、 。
(4)用焦炭还原SiO2、Al2O3会产生中间体SiC、Al4C3。写一个高温下中间体与Al2O3反应生成铝单质的化学方程式 。
(5)铝硅合金材料中若含铁,会影响其抗腐蚀性。原因是 。
(6)不计损失,投入1t铝土矿,当加入54kg纯铝后,铝硅合金中m:n = 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com