
 .
.分析 (1)过氧化钠是离子化合物,由钠离子与过氧根离子构成;
(2)高温下,碳酸钙分解生成碱性氧化物CaO,CaO和二氧化硫反应生成硫酸钙,向煤中加入石灰石作为脱硫剂,可以减少SO2的排放,生成CaSO4;
(3)分析反应中元素化合价变化,依据氧化还原反应得失电子守恒、原子个数守恒配平.
解答 解:(1)过氧化钠是离子化合物,由钠离子与过氧根离子构成,电子式为 ,故答案为:
,故答案为: ;
;
(2)高温下,碳酸钙分解生成碱性氧化物CaO,CaO和二氧化硫反应生成硫酸钙,向煤中加入石灰石作为脱硫剂,可以减少SO2的排放,生成CaSO4,反应方程式为2CaCO3+O2+2SO2$\frac{\underline{\;高温\;}}{\;}$2CaSO4+2CO2,故答案为:2CaCO3+O2+2SO2$\frac{\underline{\;高温\;}}{\;}$2CaSO4+2CO2;
(3)该氧化还原反应中Cu元素的化合价由+2价降低到+1价,硫酸铜是氧化剂,P4部分磷元素由0价降低到-3价,部分磷元素由0价升高到+5价,磷元素的化合价既升高又降低,所以P4既是氧化剂又是还原剂,
要使得失电子守恒H3PO4系数为24,Cu3P系数为20,依据原子个数守恒方程式为:11P4+60CuSO4+96H2O=24H3PO4+20Cu3P+60H2SO4,故答案为:( 11 )P4+( 60 )CuSO4+96H2O=( 20 )Cu3P+( 24 )H3PO4+60H2SO4.
点评 本题主要考查的是电子式的书写、氧化还原反应方程式的配平、工业除S等,综合性较强,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 1735Cl与1737Cl得电子能力相同 | |
| B. | 核外电子排布相同的微粒化学性质也相同 | |
| C. | Cl-、S2-、Ca2+、K+半径逐渐减小 | |
| D. | 同主族元素含氧酸的酸性随核电荷数的增加而减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 硝酸铵、氰化钠、电石和金属钠均属于电解质 | |
| B. | CN-中C元素显+2价,N元素显-3价,则非金属性N>C | |
| C. | 氰化钠是一种重要的化工原料,也是剧毒危险品,皮肤伤口接触、吸入、吞食微量可中毒死亡 | |
| D. | 电石属于危化品中的遇湿易燃固体,需贴上右图标志,其着火时不能用水灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
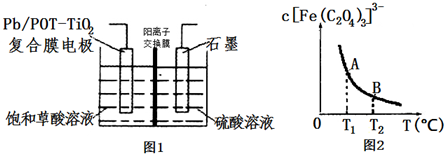
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
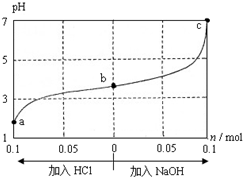
| A. | a、b、c 对应的混合液中,水的电离程度由大到小的顺序的是a>b>c | |
| B. | c点混合液中c(Na+)>c(CH3COO-) | |
| C. | 加入NaOH过程中,$\frac{c(N{a}^{+})×c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$减小 | |
| D. | 若忽略体积变化,则25℃时CH3COOH的电离平衡常数 K=$\frac{0.2}{w-0.2}$×10-7 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 化学键 | C-C | C-H | H-H | C-O | C≡0 | H-O |
| 键能(kJ•mol-1) | 348.0 | 413.0 | 436.0 | 358.0 | 1072.0 | 463.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
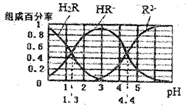
| A. | 在pH=4.4的溶液中:3c(HR-)=c(Na+)+c(H+)-c(OH-) | |
| B. | 等体积等浓度的NaOH溶液与H2R溶液混合后,溶液中水的电离程度比纯水小 | |
| C. | 在pH=3的溶液中存在 $\frac{c({R}^{2-})×c({H}_{2}R)}{c(H{R}^{-})^{2}}$=10-3.1 | |
| D. | 向Na2CO3溶液中加入少量H2R溶液,发生反应:CO32-+H2R=HCO3-+HR- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
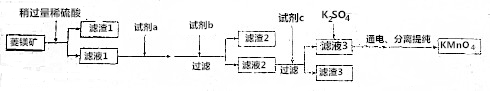
| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉定时 | 8.3 | 7.6 | 2.7 | 6.7 |
| 完全沉淀时 | 9.8 | 9.6 | 3.7 | 9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com