
 25℃时,用Na2S沉淀Cu2+、Zn2+两种金属离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示,下列说法不正确的是( )
25℃时,用Na2S沉淀Cu2+、Zn2+两种金属离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示,下列说法不正确的是( )| A. | Na2S溶液中:c(S2-)+c(HS-)+c(H2S)═2c(Na+) | |
| B. | 25℃时K甲(CuS)约为1×10-35 | |
| C. | 向100mLZn2+、Cu2+浓度均为10-5mol•L-1的混合溶液中逐滴加入10-4mol•L-1的Na2S溶液,Cu2+先沉淀 | |
| D. | 向Cu2+浓度为10-5mol•L-1的工业废水中加入ZnS粉末,会有CuS沉淀析出 |
分析 A.根据硫化钠溶液中的物料守恒判断;
B.Ksp(CuS)=c(Cu2+)×c(S2-),根据图象数据计算出25℃时K甲(CuS);
C.依据此图可知,CuS的Ksp较小,则首先出现的沉淀是CuS;
D.在25℃下,CuS溶液的是Ksp小于ZnS的溶度积,则向Cu2+浓度为10-5mol•L-1废水中加入ZnS粉末,会有CuS沉淀析出.
解答 解:A.硫化钠溶液中的物料守恒为:2c(S2-)+2c(HS-)+2c(H2S)=c(Na+),故A错误;
B.在25℃时,CuS饱和溶液中存在沉淀溶解平衡:CuS(s)?Cu2+(aq)+S2-(aq),Ksp(CuS)=c(Cu2+)×c(S2-)=10-25×10-10=10-35,故B正确;
C.依据此图可知,CuS的Ksp较小,故CuS最难溶,那么首先出现的沉淀是CuS,即Cu2+先沉淀,故C正确;
D.由于在25℃下,CuS溶液的是Ksp是10-35,小于ZnS溶度积,故向Cu2+浓度为10-5mol•L-1废水中加入ZnS粉末,会有CuS沉淀析出,故D正确;
故选A.
点评 本题主要考查了沉淀溶解平衡曲线,侧重于学生的分析能力的考查,注意掌握难溶物溶解平衡及沉淀转化的实质,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
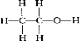 .
.| 实验序号 | 1 | 2 | 3 |
| Na2S2O3溶液体积(mL) | 19.98 | 20.02 | 21.18 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氯化亚锡有广泛的用途,工业可用作催化剂、脱氧剂等.如下是某实验室常用的一种制取无水氯化亚锡的步骤:
氯化亚锡有广泛的用途,工业可用作催化剂、脱氧剂等.如下是某实验室常用的一种制取无水氯化亚锡的步骤:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com