
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案科目:高中化学 来源: 题型:阅读理解
 本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应和答题区域内作答.若两题都做,则按A题评分.
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应和答题区域内作答.若两题都做,则按A题评分.
| 电离能/kJ?mol-1 | I1 | I2 |
| 铜 | 746 | 1958 |
| 锌 | 906 | 1733 |
| NaNO3 | KNO3 | NaCl | KCl | |
| 10℃ | 80.5 | 20.9 | 35.7 | 31.0 |
| 100℃ | 175 | 246 | 39.1 | 56.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,有下列四种溶液:①0.1mol·L-1氨水,
②0.1mol·L-1 NH4Cl溶液,③0.2mol·L-1盐酸与0.2mol·L-1NH4Cl
溶液等体积混合,④0.2mol·L-1NaOH溶液与0.2mol·L-1氨水等体
积混合,四种溶液中c(NH![]() )由大到小排列正确的是( )
)由大到小排列正确的是( )
A.②③④① B.④①②③ C.①④②③ D.③②①④
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
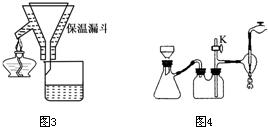
A. 海底热液研究(图1)处于当今科研的前沿。海底热液活动区域“黑烟囱”的周围常存在FeS、黄铜矿及锌矿等矿物。
(1) Ni2+的核外电子排布式是____________________。
(2) 分析下表,铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,基主要原因是 。
| 电离能/kJ·mol-1 | I1 | I2 |
| 铜 | 746 | 1958 |
| 锌 | 906 | 1733 |
(3) 下列说法正确的是________。
A. 电负性:N>O>S>C B. CO2与COS(硫化羰)互为等电子体
C. NH3分子中氮原子采用sp3杂化 D. CO、H2S、HCN都是极性分子
(4) “酸性热液”中大量存在一价阳离子,结构如图2,它的化学式为________________。
(5) FeS与NaCl均为离子晶体,晶胞相似,前者熔点为985℃,后者801℃,其原因是____________________________________________。在FeS晶胞中,与Fe2+距离相等且最近的S2-围成的多面体的空间构型为________________。
B. 制备KNO3晶体的实质是利用结晶和重结晶法对KNO3和NaCl的混合物进行分离。下面是某化学兴趣小组的活动记录:
|
| NaNO3 | KNO3 | NaCl | KCl |
| 10℃ | 80.5 | 20.9 | 35.7 | 31.0 |
| 100℃ | 175 | 246 | 39.1 | 56.6 |
查阅资料:文献中查得,四种盐在不同温度下的溶解度(S/g)如下表:
实验方案:
Ⅰ. 溶解:称取29.8g KCl和34.0g NaNO3放入250mL烧杯中,再加入70.0g蒸馏水,加热并搅拌,使固体全部溶解。
Ⅱ. 蒸发结晶:继续加热和搅拌,将溶液蒸发浓缩。在100℃时蒸发掉50.0g 水,维持该温度,在保温漏斗(如图所示)中趁热过滤析出的晶体。得晶体m1g。
Ⅲ. 冷却结晶:待溶液冷却至室温(实验时室温为10℃)后,进行减压过滤。得KNO3粗产品m2g。
Ⅳ. 重结晶:将粗产品全部溶于水,制成100℃的饱和溶液,冷却至室温后抽滤。得KNO3纯品。
假定:① 盐类共存时不影响各自的溶解度;② 各种过滤操作过程中,溶剂的损耗忽略不计。试回答有关问题:
(1) 操作Ⅱ中趁热过滤的目的是 。
(2) 若操作Ⅱ中承接滤液的烧杯中不加入蒸馏水,则理论上在操作Ⅲ中可得粗产品的质量m2=______g,其中混有NaCl______g。为防止NaCl混入,在操作Ⅱ中承接滤液的烧杯中至少应加入蒸馏水______g。
(3) 操作Ⅲ中采用减压过滤,其优点是______________________________________。该小组同学所用的装置如右图所示,试写出该装置中主要用到的玻璃仪器的名称:________________。若实验过程中发现倒吸现象,应采取的措施是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
Ⅰ)纯净的过氧化钙(CaO2)难溶于水、乙醇,常温下较为稳定。CaO2·8H2O在0℃时稳定,加热至130℃时逐渐变为无水CaO2。在实验室可用钙盐制取CaO2·8H2O,再经脱水制得CaO2。其制备过程如下:
根据以上信息,回答下列问题:
⑴用上述方法制取CaO2·8H2O的化学方程式是_▲_;
⑵测定产品中CaO2的含量的实验步骤是(己知:I2+2S2O32-=2I-+S4O62-):
第一步:准确称取ag产品于锥形瓶中,加入适量蒸馏水和过量的bgKI品体,再滴入适量2mol·L-1的H2SO4溶液,充分反应:
第二步:向上述锥形瓶中加入几滴淀粉溶液:
第三步:逐滴加入浓度为cmol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液VmL。
①第三步反应完全时的现象为 ▲ ;
②产品中CaO2的质量分数为 ▲ (用字母表示);
③某同学经实验测得产品中CaO2的质量分数偏高,造成偏高的原因是(测定过程中由操作产生的误差忽略不计,用离子方程式表示) ▲ 。
Ⅱ)硫酸铜是一种重要的化工原料,工业上常用硫酸为原料来制备硫酸铜。
⑴工业上生产硫酸过程中,焙烧硫铁矿时产生的废渣是一种二次资源。
①为了从废渣中磁选获得品位合格的铁精矿,高温下利用CO使弱磁性Fe2O3转化为强磁性Fe3O4。写出该反应的化学方程式_ ▲ _;实验发现:CO太多或太少都会导致磁铁矿产率降低,原因是 ▲ 。
②氯化焙烧工艺是将废渣用氯化钙水溶液调和、成球、高温焙烧,废渣中SiO2与CaCl2等在高温下反应放出HCl,HCl与金属氧化物等反应生成氯化物。反应生成的各金属氯化物以气态形式逸出,进而回收有色金属和回返氯化钙溶液。写出氯化焙烧工艺中生成HCl的化学方程式 ▲ 。
⑵测定硫酸铜品体中结品水含量的实验步骤为:
步骤1:准确称量一个洁净、干燥的坩埚;
步骤2:将一定量的硫酸铜晶体试样研细后,放入坩埚中称重
步骤3:将盛有试样的坩埚加热,待晶体变成白色粉末时,停止加热;
步骤4:将步骤3中的坩埚放入干燥器,冷却至室温后,称重:
步骤5: ▲ ;
步骤6:根据实验数据计算硫酸铜晶体试样中结晶水的质量分数。
请完成实验步骤5。
(3)已知硫酸铜晶体受热可以逐步失去结晶水,温度升高还可以分解生成铜的氧化物。取25.0gCuSO4·5H2O晶体均匀受热,缓慢升温至1200℃并恒温1小时,实验测得固体残留率(剩余固体的质量/原始固体质量)与温度的关系如下图所示:
在110℃时所得固体的成分为 ▲ ;在1200℃并恒温1小时,反应所得气态产物除去水后,物质的量为 ▲ 。(填字母)
A.0mol B.0.1mol C.0.125mol D.大于0.125mol
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省高三高考压轴化学试卷(解析版) 题型:实验题
(12分)本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.《物质结构与性质》2010年上海世博会场馆,大量的照明材料或屏幕都使用了发光二极管(LED)。目前市售LED品片,材质基本以GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、InGaN(氮化铟镓)为主。砷化镓的品胞结构如图10。试回答:
图10
(1)镓的基态原子的电子排布式是 。
(2)砷化镓品胞中所包含的砷原子(白色球)个数为 ,与同一个镓原子相连的砷原子构成的空间构型为 。
(3)下列说法正确的是 (填字母)。
A.砷化镓品胞结构与NaCl相同
B.第一电离能:As>Ga
C.电负性:As>Ga
D.砷化镓晶体中含有配位键
E.GaP与GaAs互为等电子体
(4)N、P、As处于同一主族,其氢化物沸点由高到低的顺序是 。
(5)砷化镓可由(CH3)3Ga和AsH3在700℃时制得。(CH3)3Ga中镓原子的杂化方式
为 。
B.《实验化学》某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究。
⑴提出假设
①该反应的气体产物是CO2。
②该反应的气体产物是CO。
③该反应的气体产物是 。
⑵设计方案 如图11所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比。

图11
⑶查阅资料
氮气不与碳、氧化铁发生反应。实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气。
请写出该反应的离子方程式: 。
⑷实验步骤
①按上图连接装置,并检查装置的气密性,称取3.20g氧化铁、2.00g碳粉混合均匀,放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水(足量)变浑浊;
④待反应结束,再缓缓通入一段时间的氮气。冷却至室温,称得硬质玻璃管和固体总质量为52.24g;
⑤过滤出石灰水中的沉淀,洗涤、烘干后称得质量为2.00g。
步骤②、④中都分别通入N2,其作用分别为 。
⑸数据处理
试根据实验数据分析,写出该实验中氧化铁与碳发生反应的化学方程式 。 ⑹实验优化 学习小组有同学认为应对实验装置进一步完善。
①甲同学认为:应将澄清石灰水换成Ba(OH)2溶液,其理由是 。
②从环境保护的角度,请你再提出一个优化方案: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com