
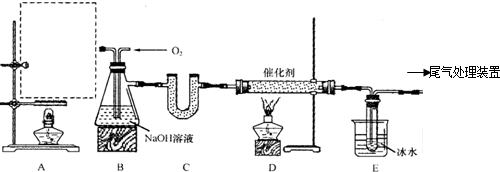
分析 装置B中盛有NaOH溶液,除了便于观察乙烯和氧气的流速以外,还具有的作用是:除去乙烯中的二氧化碳和二氧化硫,充分混合氧气和乙烯用乙醇、浓硫酸共热制乙烯,所得乙烯产率较低,原因可能是乙醇部分挥发.乙醇部分生成乙醚,乙醇被氧化为C、CO、CO2.
(1)根据实验室制取乙烯原理设计装置,注意温度计的位置;
(2)实验室利用乙醇与浓硫酸在170℃发生消去反应制乙烯;
(3)二氧化碳和二氧化硫都能被碱吸收,不能吸收的氧气、乙烯,通过观察气泡,观察乙烯和氧气的流速,混合气体通过液体,能均匀混合;
(4)若E中收集到的物质为CH3CHO,则D中乙烯被氧气氧化成乙醛;
(5)乙醇易挥发,乙醇在140℃发生分子间脱水生成乙醚,浓硫酸具有氧化性,能氧化乙醇.
解答 解:(1)实验室利用乙醇在浓硫酸的催化作用下发生分子内脱水制取乙烯,温度计应该控制混合液的温度,所以A处虚线框内缺少的装置图为: ,
,
故答案为: ;
;
(2)实验室利用乙醇能发生消去反应制乙烯:CH3-CH2-OH $→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,
故答案为:CH3-CH2-OH $→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;
(3)装置B中盛有NaOH溶液,除了便于观察乙烯和氧气的流速以外,还具有的作用是:除去乙烯中的二氧化碳和二氧化硫,充分混合氧气和乙烯,便于控制氧气、乙烯气体流量,
故答案为:除去乙烯中的二氧化碳和二氧化硫;充分混合氧气和乙烯;
(4)若E中收集到的物质为CH3CHO,则D中发生2CH2=CH2+O2$→_{△}^{催化剂}$2CH3CHO,
故答案为:2CH2=CH2+O2$→_{△}^{催化剂}$2CH3CHO;
(5)用乙醇、浓硫酸共热制乙烯,所得乙烯产率较低,原因可能是乙醇部分挥发.乙醇部分生成乙醚,乙醇被氧化为C、CO、CO2,乙醇消去生成乙烯,不能生成乙炔,ABC符合,
故答案为:ABC.
点评 本题考查了乙烯的制取装置和性质,题目难度中等,注意掌握乙烯的制取原理及装置的制取原理及装置选择,试题培养了学生灵活应用所学知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 向10mL浓度为0.1mol•L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中水的电离程度始终增大 | |
| B. | 0.01mol•L-1CH3COOH溶液中水的电离程度小于0.01mol•L-1盐酸中水的电离程度 | |
| C. | 将0.01mol•L-1盐酸与pH=12的氨水等体积混合,所得溶液中由水电离出的c(OH-)<1×10-7mol•L-1 | |
| D. | 将0.01mol•L-1的CH3COOH溶液与pH=12的氨水等体积混合,所得溶液中由水电离出的c(OH-)>1×10-7mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2g | B. | 3g | C. | 3.5g | D. | 4.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
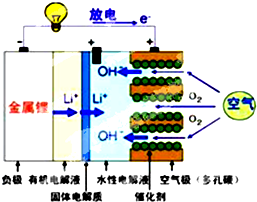 美国IBM公司设计出了一款新型锂空气电池,其原理就是通过吸入空气与设备内的锂离子发生反应,进行能量的提供.因其独特的放电方式,也称呼吸式电池.负极采用金属锂条,负极的电解液采用含有锂盐的有机电解液.中间设有用于隔开正极和负极的锂离子固体电解质.正极的水性电解液使用碱性水溶性凝胶,与由微细化碳和廉价氧化物催化剂形成的正极组合.如图所示.下列说法不正确的是( )
美国IBM公司设计出了一款新型锂空气电池,其原理就是通过吸入空气与设备内的锂离子发生反应,进行能量的提供.因其独特的放电方式,也称呼吸式电池.负极采用金属锂条,负极的电解液采用含有锂盐的有机电解液.中间设有用于隔开正极和负极的锂离子固体电解质.正极的水性电解液使用碱性水溶性凝胶,与由微细化碳和廉价氧化物催化剂形成的正极组合.如图所示.下列说法不正确的是( )| A. | 负极反应:Li-e-=Li+,金属锂以锂离子(Li+)的形 式溶于有机电解液,电子供应给导线.溶解的锂离子(Li+)穿过固体电解质移到正极的水性电解液中 | |
| B. | 正极反应:O2+2H2O+4e-=4OH-,在正极的水性电解液中与锂离子(Li+)结合生成水溶性氢氧化锂(LiOH),并能实现锂元素的循环 | |
| C. | 在负极的有机电解液和空气极的水性电解液之间,用只能通过锂离子的固体电解质隔开,以防止两电解液发生混合,而且能促进电池发生反应 | |
| D. | 锂-空气电池至今都未普及,原因是它存在致命缺陷,即固体反应生成物氧化锂(Li2O)在正极堆积,使电解液与空气的接触被阻断,从而导致放电停止 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、Cl-、F- | B. | Fe2+、ClO-、NO3-、Na+ | ||
| C. | Fe2+、Mg2+、SO42-、Cl- | D. | CO32-、SO42-、Na+、K+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com