
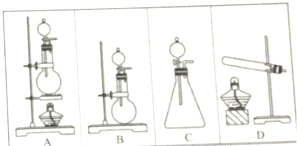
 实验室里现有下列装置和试剂制取少量氯化氢气体时选用:①浓硫酸②浓盐酸③食盐固体④硫酸氢钠固体⑤二氧化锰固体请用实验装置编号回答:
实验室里现有下列装置和试剂制取少量氯化氢气体时选用:①浓硫酸②浓盐酸③食盐固体④硫酸氢钠固体⑤二氧化锰固体请用实验装置编号回答:分析 (1)浓硫酸与浓盐酸混合放热,HCl挥发;
(2)浓硫酸与氯化钠在加热条件下生成HCl;
(3)把浓盐酸滴到浓硫酸中可以快速制备HCl.
解答 解:(1)浓硫酸与浓盐酸混合放热,HCl挥发,所以选用①②两试剂时,应选择“液+液”不加热型气体发生装置B或C,故答案为:B或C;
(2)浓硫酸与氯化钠在加热条件下生成HCl,若选用试剂①③,应选择“固+液”加热型气体发生装置A,故答案为:A;
(3)把浓盐酸滴到浓硫酸中可以快速制备HCl,需要选择①②两试剂,相应的“液+液”不加热型气体发生装置是B或C,故答案为:B或C.
点评 本题考查了气体的制备,侧重于考查实验原理和仪器的选择,题目难度不大,注意根据试剂的状态和反应条件分析.


科目:高中化学 来源: 题型:选择题
| A. | 向Ba(OH)2溶液中加入NaHSO4溶液至刚好沉淀完全:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | Cu与浓H2SO4 共热:Cu+4H++SO42-$\frac{{\underline{△}}}{\;}$ZCu2++SO2↑+2H2O | |
| C. | 向FeSO4溶液中滴加H2O2溶液:Fe2++H2O2+2H+═Fe3++2H2O | |
| D. | 将SO2通入Ca(ClO)2溶液:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
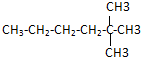 用“键线式”可表示为
用“键线式”可表示为 ,其中每个端点和转折点都表示一个碳原子,氢原子已省略.某有机物分子用键线式表示为
,其中每个端点和转折点都表示一个碳原子,氢原子已省略.某有机物分子用键线式表示为 ,该有机物的分子式为:C10H20,其一氯代物有4种.
,该有机物的分子式为:C10H20,其一氯代物有4种.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.68g | B. | 0.81g | C. | 0.91g | D. | 1.21g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题



查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com