
下列实验能达到预期目的的是
①用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸
②将Cl2的制备和性质实验联合进行,以减少实验中的空气污染
③用食醋和澄清石灰水验证蛋壳中含有碳酸盐
④用溴水检验汽油中是否含有不饱和烃
A.①②③ B.①③④
C.②③④ D.①②④
科目:高中化学 来源:2014-2015学年湖北省高二上学期期中考试试化学试卷(解析版) 题型:选择题
已知同温度下,三种酸的电离平衡常数的大小关系为Ka(HX)>Ka(HY)>Ka(HZ),则物质的量浓度相同的三种盐NaX、NaY和NaZ溶液pH由大到小的顺序是
A.NaX NaY NaZ B.NaX NaZ NaY
C.NaY NaZ NaX D.NaZ NaY NaX
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省高二上学期期中考试化学试卷(解析版) 题型:选择题
常温,下列各组离子在指定溶液中能大量共存的是
A.pH=1的溶液中:I-、NO3-、SO42-、Na+
B.由水电离的c(H+)=1×10-14mol/L的溶液中:Ca2+、K+、Cl-、HCO3-
C.c(H+)/c(OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl-
D.c(Fe3+)=0.1mol/L的溶液中:K+、ClO-、SO42-、SCN-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省高二上学期10月月考化学试卷(解析版) 题型:实验题
如图所示一套实验装置来制取乙酸乙酯

A中盛有乙醇、浓硫酸和醋酸的混合液,C中盛有饱和碳酸钠溶液。
已知:①氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH,②有关有机物的沸点:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点(℃) | 34.7 | 78.5 | 117.9 | 77.1 |
(1)浓硫酸的作用是 ;
(2)若实验中用含18O的乙醇与乙酸作用,则表示该反应原理的化学方程式是 ;
(3)球形管B除起冷凝作用外,另一重要作用是 ;
(4)反应中所用的乙醇是过量的,其目的是 ;
(5)从C中分离出乙酸乙酯必须使用的一种仪器是______;分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入饱和氯化钙溶液分离出__________,再加入无水硫酸钠,然后进行蒸馏,收集77℃的馏分,以得到较纯净的乙酸乙酯。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省高二上学期10月月考化学试卷(解析版) 题型:选择题
实验室中,下列除去括号内杂质的有关操作正确的是
A.苯(硝基苯):加少量蒸馏水振荡,待分层后分液
B.乙醇(水):加新制的生石灰,蒸馏
C.CO2(HCl、水蒸气):通过盛有碱石灰的干燥管
D.乙烷(乙烯):通入氢气发生加成反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北武汉新洲三中高二10月月考化学(A卷)试卷(解析版) 题型:实验题
某实验小组用0.55 mol/L NaOH溶液和0.50 mol/L盐酸反应来测定中和热,实验装置如下图所示。
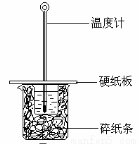
(1)图示实验装置中缺少的一种仪器是 ,大、小烧杯间填满碎纸条的作用是 。
(2)取50 mL NaOH溶液和50mL盐酸进行实验,实验数据如下表:
①请填写下表中的空白:
温度
次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.1 | 3.0 |
2 | 25.9 | 25.9 | 25.9 | 28.8 | |
3 | 26.4 | 26.2 | 26.3 | 29.4 | |
②近似认为0.55mol/L NaOH溶液和0.50 mol/L盐酸的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热△H= (结果保留小数点后一位)。
③氢氧化钠溶液稍过量的原因是 。
④上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是 (填字母)。
a. 实验装置保温、隔热效果差
b. 用量筒量取盐酸时俯视读数
c. 分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d. 用温度计测定NaOH溶液起始温度后直接测定盐酸的温度
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北武汉新洲三中高二10月月考化学(A卷)试卷(解析版) 题型:选择题
a mol N2与b mol H2混合,要一定条件下反应达到平衡,生成了c mol NH3,则NH3在平衡体系中质量分数为( )
A. B.
B. 
C. D.
D.
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省绍兴市高一上学期期中化学试卷(解析版) 题型:填空题
现用18.4 mol·L-1的浓硫酸来配制480mL 0.2 mol·L-1的稀硫酸,可供选择的仪器有:
①玻璃棒 ②烧杯 ③胶头滴管 ④药匙 ⑤托盘天平⑥量筒
(1)上述仪器在配制过程中不需要用到的是__________________。(填序号)除上述仪器外,尚缺最重要的仪器是 。
(2)需要用量筒量取浓硫酸的体积为___________mL。
(3)实验中用到玻璃棒,其作用分别是:___________、__________。
(4)配制时,一般可分为以下几个步骤:
①量取 ②计算 ③稀释 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却。
其正确的操作顺序为:②→①→③→____ →____→____→____→④(填序号)
(5)在配制过程中,下列操作可引起所配溶液浓度偏低的有____________(填序号)
①定容时,仰视刻度线。
②未冷却至室温就转移到容量瓶中。
③容量瓶中含有少量蒸馏水。
④未洗涤稀释浓硫酸时用过的烧杯和玻璃棒。
⑤定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线。
(6)取所配制的稀硫酸100mL,与一定质量的锌充分反应,锌全部溶解后,生成的气体在标准状况下的体积为0.224L,则参加反应的锌的质量为 g,设反应后溶液的体积仍为100mL,则反应后溶液中H+的物质的量浓度为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省温州市十校联合体高二上学期期中联考化学试卷(解析版) 题型:选择题
在H2O中加入等物质的量的Ag+、Na+、Ba2+、NO3-、SO42-、Cl-,该溶液在惰性电极的电解 槽中通电片刻后,氧化产物和还原产物的质量比是
A.1:2 B.8:1 C.35.5:108 D.108:35.5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com