
空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下:
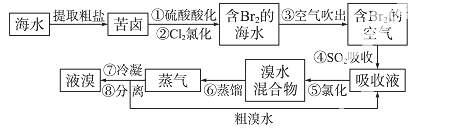
(1)溴在周期表中位于第 _周期第 _族。
(2)步骤①中用硫酸酸化可提高Cl2的利用率,理由是 _。
(3)步骤④利用了SO2的还原性,反应的离子方程式为 _。
(4)步骤⑥的蒸馏过程中,温度应控制在80~90 ℃。温度过高或过低都不利于生产,请解释原因 _。
(5)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离。分离仪器的名称是 _。
(6)步骤①、②之后并未直接用“含Br2的海水”进行蒸馏得到液溴,而是经过“空气吹出”、“SO2吸收”、“氯化”后再蒸馏,这样操作的意义是 _。
【答案】23. (14分)(1)4 ⅦA,(2)酸化可抑制Cl2 .Br2与水反应.
(3)2H2O+SO2+Br2===4H++SO42-+2Br-
(4)温度过高,产生大量水蒸气,溴蒸气中水蒸气增加.温度过低,溴不能完全蒸出,吸收率低.
(5)分液漏斗 (6)“空气吹出”、“SO2吸收”、“氯化”过程实际上是一个Br2的浓缩过程,与直接蒸馏含Br2海水相比效率更高,消耗能更少,成本降低
【解析】
试题分析:(1)因溴在氯的下一周期,与氯在同一主族,所以溴在周期表中位于第4周期VIIA族,(2)氯气、溴单质与水之间能发生反应,酸化可抑制它们与水的反应,所以步骤①中用硫酸酸化可提高Cl2的利用率,理由是:酸化可抑制Cl2、Br2与水反应;(3)因SO2和氯气、水反应生成硫酸和氢溴酸:Br2+SO2+2H2O=2HBr+H2SO4,故答案为:Br2+SO2+2H2O=4H++2Br-+SO42-;(4)在溴水中,溴的沸点是58.5°C,水的是100°C,温度过高,大量水蒸气随之排出,溴气中水分增加;温度过低,溴不能完全蒸出,产率低,所以答案为:温度过高,大量水蒸气随之排出,溴气中水分增加;温度过低,溴不能完全蒸出,产率低;(5)因液溴与溴水不相溶,用分液漏斗分离,所以答案为:分液漏斗;(6)海水中溴离子的含量较少,在海水提取溴之前,必须进行海水浓缩,所以答案为:“空气吹出、SO2吸收、氯化”的过程实际上是一个Br2的浓缩过程,与直接蒸馏含Br2海水相比效率更高,消耗能少,成本降低.
考点:考查海水资的综合利用,氯、溴、碘及其化合物的制取、性质及综合应用等知识。


科目:高中化学 来源: 题型:
等物质的量的CO和CO2相比较,下列有关叙述中正确的是( )
①它们所含的分子数之比为1∶1 ②它们所含的O原子数目之比为1∶2 ③它们所含的原子总数目之比为2∶3 ④它们所含的C原子数目之比为1∶1 ⑤它们所含的电子数目之比为7∶11
A.①和④ B.②和③
C.④和⑤ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验方法能达到目的的是
A.用氨水清洗试管内壁附着的银镜
B.用饱和Na2CO3溶液除去乙醇中少量的乙酸和水
C.制备Fe(OH)3胶体,向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸
D.可用K3[Fe(CN)6]溶液鉴定FeCl3溶液中是否存在Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学用语的相关表述正确的是
A.H+(aq)+OH-(aq)=H2O(l) △H=-a kJ/mol,故1 mol NaOH固体与足量的稀盐酸反应,放出热量为a kJ
B.因CuSO4·5H2O(s)=CuSO4(s)+5H2O(1) △H=+b kJ/mol,故1 mol CuSO4(s)溶于足量水时,放出热量为b kJ
C.因氢气的燃烧热为c kJ/mol,故电解水的热化学方程式为:2H2O(1)=2H2(g)+O2(g)△H=+c kJ/mol
D.因N2(g)+3H2(g) 2NH3(g) △H=-d kJ/mol,故在某容器中投入1 mol N2与3 mol H2充分反应后,放出热量小于d kJ
2NH3(g) △H=-d kJ/mol,故在某容器中投入1 mol N2与3 mol H2充分反应后,放出热量小于d kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组测定某FeCl3样品(只含少量FeCl2杂质)中铁元素的质量分数,按以下实验步骤进行操作:
① 称取a g样品,置于烧杯中;
② 加入适量盐酸和蒸馏水,使样品溶解,然后准确配制成250.00mL溶液;
③ 量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,使反应完全;
④ 加入过量氨水,充分搅拌,使沉淀完全;
⑤ 过滤,洗涤沉淀;
⑥ 将沉淀转移到某容器内,加热、搅拌,直到固体由红褐色全部变为红棕色后,在干燥器中冷却至室温后,称量;
⑦……。
请根据上面叙述,回答:
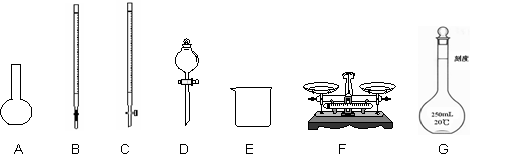
(1)上图所示仪器中,本实验步骤①②③中必须用到的仪器是E,F和 (填字母)。
(2)步骤②中加入盐酸的作用____________________________ ______。
(3)写出步骤④中发生反应的离子方程式 。
(4)样品中的杂质Fe2+有较强的还原性,完成并配平下列反应的离子方程式
___Fe2+ + ___ClO3— + = __Fe3+ + ___Cl— + ___H2O
从理论上分析,上述实验中若将氯水改为NaClO3时,对实验结果造成 (填偏大、偏小或不影响).
(5)第⑥步的操作中,将沉淀物转移到 (填仪器名称)中加热,冷却至室温,称量其质量为m1g.
(6)本实验若容器质量是W1 g,最终容器和固体的总质量是W2 g,则样品中铁元素的质量分数为 。(列出算式,不需化简)
(7)已知Cl2与热的NaOH溶液可发生如下反应:
3Cl2 + 6NaOH  5NaCl + NaClO3 + 3H2O
5NaCl + NaClO3 + 3H2O
则Fe3+、KClO3、Cl2三种物质其氧化性在酸性溶液由强到弱的顺序是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在电子工业中,制印刷电路时,常用氯化铁溶液作为铜的腐蚀液,该过程发生的反应为2FeCl3+Cu===2FeCl2+CuCl2。该反应利用了铜的什么性质( )
A.氧化性 B.还原性
C.导电性 D.导热性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com