
【题目】已知有以下物质相互转化:

请回答下列问题:
(1)写出B的化学式___________,D的化学式为____________;
(2)写出由E转变成F的化学方程式________。
(3)写出D转化成H的离子方程式_________。
(4)除去溶液B中混有的少量G溶液的最适宜方法是________。
【答案】FeCl2 KCl 4Fe(OH)2+O2+2H2O=4Fe(OH)3 Ag++Cl-=AgCl↓ 向溶液B中加入足量铁粉,再经过滤操作
【解析】
D和硝酸银、稀硝酸的混合溶液反应生成沉淀H和焰色反应呈紫色的溶液可知,H为AgCl,D为KCl,白色沉淀E在空气中变成红褐色沉淀F可知E为Fe(OH)2,F为Fe(OH)3,所以G为FeCl3,A为Fe,B为FeCl2,C为NaOH,据此解答。
(1)由分析可知,B为FeCl2,D为KCl,故答案为:FeCl2;KCl;
(2)E为Fe(OH)2,F为Fe(OH)3,反应的方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)D为KCl,H为AgCl,D转化为H的离子方程式为:Ag++Cl-=AgCl↓,故答案为:Ag++Cl-=AgCl↓;
(4)FeCl2中混有的少量FeCl3,可用过量的铁粉将FeCl3转化为FeCl2,过量的铁粉用过滤除去,故答案为:向溶液B中加入足量铁粉,再经过滤操作。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案科目:高中化学 来源: 题型:
【题目】我国科学家研发了一种室温下“可呼吸”的Na—CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na![]() 2Na2CO3+C。下列说法错误的是
2Na2CO3+C。下列说法错误的是

A. 放电时,ClO4-向负极移动
B. 充电时释放CO2,放电时吸收CO2
C. 放电时,正极反应为:3CO2+4e =2CO32-+C
D. 充电时,正极反应为:Na++e=Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研发了一种室温下“可呼吸”的Na—CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na![]() 2Na2CO3+C。下列说法错误的是
2Na2CO3+C。下列说法错误的是

A. 放电时,ClO4-向负极移动
B. 充电时释放CO2,放电时吸收CO2
C. 放电时,正极反应为:3CO2+4e =2CO32-+C
D. 充电时,正极反应为:Na++e=Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.2 mol /L H2A溶液中滴加0.2 mol /L NaOH溶液。有关微粒的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)所示。根据图示判断,下列说法正确的是
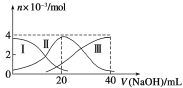
A.当V(NaOH)=20 mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(A2-) >c(H+) >c(OH-)
B.等浓度的NaOH溶液与H2A溶液按2∶1混合后,其溶液中水的电离程度比纯水大
C.NaHA溶液中:c(OH-)=c(H+)+c(HA-)+2c(H2A)
D.向上述加入20 mL NaOH溶液后所得溶液中再加入水的过程中,pH可能减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二元酸(化学式用H2B表示)在水中的电离方程式是:H2B=H++HB-;HB-![]() H++B2-,回答下列问题:
H++B2-,回答下列问题:
(1)NaHB溶液显___(填“酸性”、“中性”或“碱性”或“无法确定”),理由是_______。
(2)某温度下,向0.1 mol·L-1 的NaHB溶液中滴入0.1 mol·L-1 KOH溶液至中性,此时溶液中以下关系一定正确的是________(填序号)。
a.c(H+)·c(OH-)=1×10-14 b.c(Na+)+c(K+)=c(HB-)+2c(B2-)
c.c(Na+)>c(K+) d.c(Na+)+c(K+)=0.05 mol·L-1
(3)已知0.1 mol·L-1NaHB溶液的pH=2,则0.1 mol·L-1H2B溶液中氢离子的物质的量浓度可能是________0.11 mol·L-1(填“<”、“>”或“=”); 理由是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】链烃A的核磁共振氢谱显示只含有一种氢原子,A的质谱图中显示其最大质荷比为84,A的红外光谱表明分子中含有碳碳双键。
(1)A的结构简式为____。
(2)在图中,D1、D2互为同分异构体,E1、E2互为同分异构体。
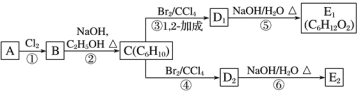
C的化学名称是___;反应⑤的化学方程式为____;E2的结构简式是____;②、⑥的反应类型依次____、___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐在能源、环保等方面有着广泛的用途。利用湿法、干法制备高铁酸盐的原理如表所示。
湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
干法 | Fe2O3、KNO3、KOH混合加热生成紫红色高铁酸盐和KNO2等产物 |
(1)工业上利用湿法制备高铁酸钾(K2FeO4)的流程如图所示:
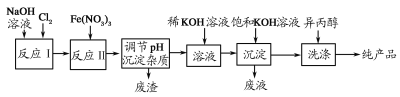
①反应Ⅰ的化学方程式为_____________。
②反应Ⅱ的离子方程式为_______________。
③加入饱和KOH溶液的目的_____________。
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为___________。
(3)干法制备K2FeO4的反应中,氧化剂是________。
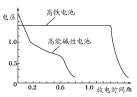
(4)高铁电池是正在研制中的可充电干电池,如图为该电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生做浓硫酸性质的实验:
在一支试管中放入一块很小的铜片,再加入2mL浓硫酸,然后把试管固定在铁架台上。把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中。塞紧试管口,在玻璃管口处缠放一团蘸有NaOH溶液的棉花。加热试管,观察现象。
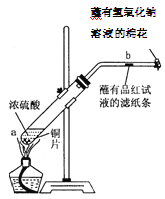
回答下列问题:
(1)写出试管中发生反应的化学方程式____________________。
(2)试管中的液体反应一段时间后,b处滤纸条的变化为_______________,待试管中反应停止后,给玻璃管放有蘸过品红溶液的滤纸处微微加热,滤纸条的变化为_____________。
(3)蘸有NaOH溶液的棉花团作用是________________________________________。
(4)硫酸型酸雨的形成过程可用下列反应中的__________来表示。
A:SO2+H2O![]() H2SO3
H2SO3
B:O2+2H2SO3=2H2SO4
C:SO2+H2O2=H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮和硫的化合物在工农业生产、生活中具有重要应用。请回答下列问题:
![]() 航天领域中常用
航天领域中常用![]() 作为火箭发射的助燃剂。
作为火箭发射的助燃剂。![]() 与氨气相似,是一种碱性气体,易溶于水,生成弱碱
与氨气相似,是一种碱性气体,易溶于水,生成弱碱![]() 用电离方程式表示
用电离方程式表示![]() 显碱性的原因是:________________。
显碱性的原因是:________________。
![]() 在恒温条件下,
在恒温条件下,![]() 和足量C发生反应
和足量C发生反应![]() ,测得平衡时
,测得平衡时![]() 和
和![]() 的物质的量浓度与平衡总压的关系如图所示:
的物质的量浓度与平衡总压的关系如图所示:
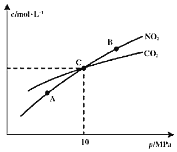
![]() 、B两点的浓度平衡常数关系:
、B两点的浓度平衡常数关系:![]() ______
______![]() 填“
填“![]() ”或“
”或“![]() ”或“
”或“![]() ”
”![]()
![]() 、B、C三点中
、B、C三点中![]() 的转化率最高的是______
的转化率最高的是______![]() 填“A”或“B”或“C”
填“A”或“B”或“C”![]() 点。
点。
![]() 计算C点时该反应的压强平衡常数
计算C点时该反应的压强平衡常数![]() ______
______![]() 是用平衡分压代替平衡浓度计算,分压
是用平衡分压代替平衡浓度计算,分压![]() 总压
总压![]() 物质的量分数
物质的量分数![]() 。
。
![]() 已知:亚硝酸
已知:亚硝酸![]() 性质和硝酸类似,但它是一种弱酸。常温下亚硝酸的电离平衡常数
性质和硝酸类似,但它是一种弱酸。常温下亚硝酸的电离平衡常数![]() ;
;![]() 的
的![]() ,
,![]() 在常温下向含有2mol碳酸钠的溶液中加入1mol的
在常温下向含有2mol碳酸钠的溶液中加入1mol的![]() 后,则溶液中
后,则溶液中![]() 、
、![]() 和
和![]() 的离子浓度由大到小的顺序是______。
的离子浓度由大到小的顺序是______。
![]() 已知:常温下甲胺
已知:常温下甲胺![]() 的电离常数为
的电离常数为![]() ,且
,且![]() 水溶液中有
水溶液中有![]() ,常温下向
,常温下向![]() 溶液滴加稀硫酸至
溶液滴加稀硫酸至![]() 时,则溶液
时,则溶液![]() ______。
______。
![]() 一种煤炭脱硫技术可以把硫元素以
一种煤炭脱硫技术可以把硫元素以![]() 的形成固定下来,但产生的CO又会与
的形成固定下来,但产生的CO又会与![]() 发生化学反应,相关的热化学方程式如下:
发生化学反应,相关的热化学方程式如下:![]()
![]()
![]() ,反应
,反应![]() ______
______![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com