
分析 (1)降低压强平衡向气体体积增大的方向移动,据此判断;
(2)C是气体,且x+y=z,在加压时化学平衡可发生移动,说明X、Y至少有1种不是气体,增大压强平衡向气体体积减小的方向移动;
(3)B、C是气体,增加A物质的量(其他条件不变),平衡不移动,说明A是固体或纯液体.
解答 解:(1)A、B、C都是气体,在减压后平衡向逆反应方向移动,降低压强平衡向气体体积增大的方向移动,即x+y>z,
故答案为:x+y>z;
(2)C是气体,且x+y=z,在加压时化学平衡可发生移动,说明X、Y至少有1种不是气体,逆反应是气体体积减小的反应,故平衡向逆反应方向移动,
故答案为:逆反应;
(3)B、C是气体,增加A物质的量(其他条件不变),平衡不移动,说明A是固体或纯液体,即A为非气态
故答案为:固体或纯液体.
点评 本题考查化学平衡的影响因素,难度不大,注意压强对平衡移动的影响,化学平衡移动原理是解题关键.


 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:选择题
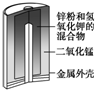 |  | 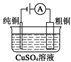 | 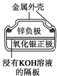 |
| 图Ⅰ 碱性锌锰电池 | 图Ⅱ 铅硫酸蓄电池 | 图Ⅲ 电解精炼铜 | 图Ⅳ 银锌纽扣电池 |
| A. | 图Ⅰ所示电池中,MnO2的作用是催化剂 | |
| B. | 图Ⅱ所示电池充电过程中,阳极的反应为:PbSO4+2H2O+2e-═PbO2+SO42-+4H+ | |
| C. | 图Ⅲ所示装置工作过程中,若阳极质量减少6.4 g,则电路中转移电子数为0.2×6.02×1023 | |
| D. | 图Ⅳ所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
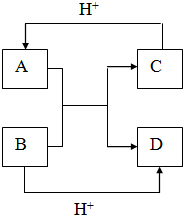 写出下列微粒的化学式
写出下列微粒的化学式查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:Q>W>Z>Y | |
| B. | 元素Y、Q的气态氢化物稳定性:Q>Y | |
| C. | 元素Z、W、Q的最高价氧化物对应水化物相互间能发生反应 | |
| D. | Y与X、Y与Z形成的化合物化学键类型相同. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
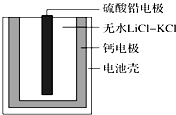 热激活电池可用作火箭、导弹的工作电源.一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能.该电池总反应为PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.下列有关说法正确的是( )
热激活电池可用作火箭、导弹的工作电源.一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能.该电池总反应为PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.下列有关说法正确的是( )| A. | 正极反应式:Ca+2Cl--2e-=CaCl2 | |
| B. | 放电过程中,Li+向负极移动 | |
| C. | 常温时,在正负极间接上电流表或检流计,指针发生偏转 | |
| D. | 每转移0.1 mol电子,理论上生成10.35g Pb |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠在自然界中能以游离态存在 | |
| B. | 金属钠着火时,用细沙覆盖灭火 | |
| C. | 易燃试剂与强氧化性试剂分开放置并远离火源 | |
| D. | 钠在空气中燃烧生成过氧化钠 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com