
| A、1 molA和1 molB的质量相同 | ||
| B、1 molA和1 molB中所含的质子数相同 | ||
C、1molA和
| ||
D、
|
| ||
| 156 |
| a |
| ||
| 156 |
| a |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
| A、用溶解、过滤的方法分离CaCl2和NaCl的固体混合物 |
| B、用澄清石灰水检验CO中是否含有CO2 |
| C、用酒精把碘水中的碘萃取出来 |
| D、用BaCl2除去NaOH溶液中混有的少量Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
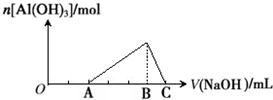
| A、原混合溶液中c(Fe3+):c(Al3+)=1:1 |
| B、Fe(NO3)3溶液中混有杂质Al(NO3)3可以加入过量的NaOH溶液除去 |
| C、B点两种沉淀共存,此时上层溶液中c(Al3+):c(Fe3+)=2.5×104 |
| D、C点溶液中的溶质只有NaAlO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、室温时,1L pH=2的NH4Cl溶液中水电离出10-12mol H+ |
| B、常温常压下,46g NO2含有的原子数小于3NA |
| C、12g石墨含有4NA个自由移动的电子 |
| D、1mol LiAlH4在125℃完全分解成LiH、H2、Al,转移电子3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu2+、Na+、NO3-、Cl- |
| B、NH4+、Mg2+、NO3-、CO32- |
| C、Ag+、Na+、CO3-、Cl- |
| D、Na+、K+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| △ |
| 改变条件 | 速率变化 |
| 降低温度 | |
| 增加O2的浓度 | |
| 使用V2O5做催化剂 | |
| 压缩气体 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com