
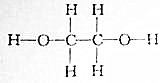
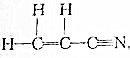
分析 (1)根据成键两原子间共用电子对是否有偏移,可将共价键分为极性键和非极性键;同种元素原子之间形成非极性键,不同元素原子之间形成极性键;
(2)依据成键两原子间共用电子的对数可将共价键分为单键、双键、三键.
解答 解:(1)成键两原子间共用电子对发生偏移为极性键,成键两原子间共用电子对不发生偏移为非极性键,乙二醇中碳与氧、碳与氢之间形成极性键,碳与碳之间形成非极性键,
故答案为:极性键、非极性键;极性键、非极性键;
是否有偏移,可将共价键分为极性键和非极性键;同种元素原子之间形成非极性键,不同元素原子之间形成极性键;
(2)依据成键两原子间共用电子的对数可将共价键分为单键、双键、三键,丙烯腈分子中含有碳氢单键、碳碳单键、碳碳双键、碳氮三键,
故答案为:单键、双键、三键;单键、双键、三键.
点评 本题考查共价键分类,注意从共用电子对偏移、共用电子对数、电子云重叠理解共价键类型,注意理解共价键极性与分子极性.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | ②③④ | B. | ①②④ | C. | ①②③ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | 1-己醇的沸点比己烷的沸点高89℃ | 1-己醇和己烷可通过蒸馏初步分离 |
| B | 原电池可将化学能转化为电能 | 原电池需外接电源才能工作 |
| C | H2SO4是离子化合物 | 硫酸溶液可导电 |
| D | 乙二酸可与KMnO4溶液发生反应 | 乙二酸具有酸性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 能使潮湿的有色布条褪色 | |
| B. | 钠在氯气中燃烧,生成白色的烟 | |
| C. | 纯净的H2在Cl2中安静地燃烧,发出苍白色火焰,集气瓶口呈现白色烟雾 | |
| D. | 氯气能与水反应生成次氯酸和盐酸,久置氯水最终变为稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
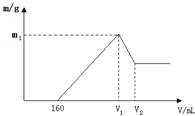 将镁铝的混合物0.1mol溶于100mL2mol/L硫酸溶液中,然后再滴加1mol/L氢氧化钠溶液,请回答以下问题:
将镁铝的混合物0.1mol溶于100mL2mol/L硫酸溶液中,然后再滴加1mol/L氢氧化钠溶液,请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
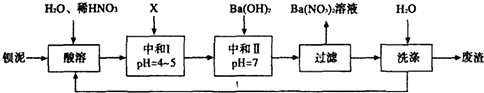
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com