(2013?金华模拟)对化学反应的研究需要从反应条件、限度、速率、定量关系等因素进行综合分析.下列是关于化学反应的系列研究,请根据相关信息回答问题.
I.关于反应物之间的定量关系的研究:
(1)已知反应:2I
-+2Fe
3+=I
2+2Fe
2+,向100mL,0.1moL?L
-1的FeI
2溶液中通入0.01mol Cl
2,该反应的离子方程式为
2I-+Cl2=I2+2Cl-
2I-+Cl2=I2+2Cl-
.
(2)298K时,Mg(OH)
2的溶度积常数Ksp=5.6×10
-12,将物质的量浓度均为2×10
-4mol?L
-1的氯化镁溶液和氢氧化钠溶液等体积混合,能否产生氢氧化镁沉淀?
否
否
(填“能”或“否”).
Ⅱ,关于反应速率、限度的研究:
近段时间,全国范围内的雾霾天气严重影响了人们的身体健康.环境问题越来越受到人们的重视.汽车尾气中含有较多的NO和CO,两种气体均会使人体中毒.以CO为例,其中毒原理是相同温度下CO与血红蛋白的结合能力远远大于氧气与血红蛋白的结合能力,反应如下:CO+HbO
2?O
2+HbCO(HbO
2表示氧合血红蛋白).
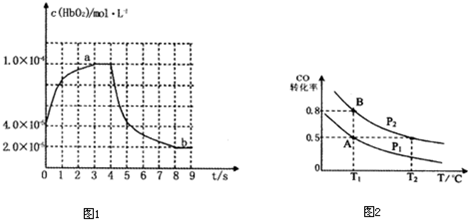
如图表示HbO
2浓度随时间的变化:曲线a表示向血样中通入氧气后的变化;曲线b表示在第4s时通入CO和O
2混合气体后的变化.
(3)前3s以HbO
2表示的平均反应速率为
2×10-5mol/(L?s)
2×10-5mol/(L?s)
;第9s时,HbCO的浓度为
8×10-5
8×10-5
mol?L
-1.
(4)37℃时,CO+HbO
2?O
2+HbCO,该反应的平衡常数K=220,资料显示HbCO的浓度达到HbO
2浓度的0.022倍,就会导致人体智力受损.据此,通过计算可知,当吸入的CO与O
2浓度之比大于或等于
时,人的智力将会受到伤害.
(5)一氧化碳、氢气既是重要的能源,也可以催化还原NO等消除污染,还可以在一定条件下制取CH
3OH.已知
N
2(g)+O
2(g)=2NO((g)△H=+180.5kJ?mol
-12H
2(g)+O
2(g)=2H
2O(1)△H=-571.6kJ?mol
-1H
2O(g)=H
2O(1)△H=-44kJ?mol
-1写出H
2与NO反应生成N
2和水蒸气的热化学方程式
2H2(g)+2NO(g)=2H2O(g)+N2(g)△H=-664.1kJ/mol
2H2(g)+2NO(g)=2H2O(g)+N2(g)△H=-664.1kJ/mol
.
(6)在一容积可变的密闭容器中充入10mol CO和20molH
2,在催化剂存在时反应生成甲醇:CO(g)+2H
2(g)?CH
3OH(g),CO的平衡转化率随温度(T)、压强(P)的变化如右图所示,当达到平衡状态A时,容器的体积为10L.如反应开始时仍充入10mol CO和20mol H
2,则在平衡状态B时容器的体积V(B)=
2
2
L.




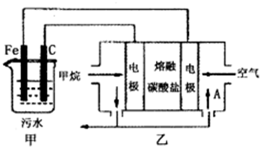 (2013?金华模拟)工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3.Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用该原理处理污水,设计装置如图所示.下列说法正确的是( )
(2013?金华模拟)工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3.Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用该原理处理污水,设计装置如图所示.下列说法正确的是( )