
合金是指两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质。分析下
表数据,不能形成合金的是

A.Cu和Al B.Fe和Na C.Fe和Cu D.Al和Na
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2015-2016学年河北省高二9月月考化学试卷(解析版) 题型:选择题
2A(g)+B(g)  3C(g)+4D(g)的反应,在不同条件下的反应的速率最快的是
3C(g)+4D(g)的反应,在不同条件下的反应的速率最快的是
A.v(A) = 0.7mol·L-1·min-1
B.v (B) = 0.3mol·L-1·min-1
C.v (C) = 0.9mol·L-1·min-1
D.v (D) = 1.1mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省邯郸市高一上第一次月考化学试卷(解析版) 题型:选择题
300 mL Al2(SO4)3溶液中,含Al3+为1.62 g,在该溶液中加入0.1 mol/L Ba(OH)2溶液300 mL,反应后溶液中SO42-的物质的量浓度约为
A.0.4 mol/L B.0.3 mol/L
C.0.2 mol/L D.0.1 mol/L
查看答案和解析>>
科目:高中化学 来源:2016届河北省冀州市高三复习班上第一次月考化学试卷A(解析版) 题型:选择题
一定条件下,中学化学常见物质甲、乙之间存在如下转化关系,乙是

A.HCl B.FeCl2 C.KOH D.NaHCO3
查看答案和解析>>
科目:高中化学 来源:2016届河北省高三上学期二调化学试卷(解析版) 题型:选择题
1.76克铜镁合金完全溶解于50 mL、密度为1.40 g/cm3、质量分数为63%的浓硝酸中,得到N02气体1792 mL(标准状况),向反应后的溶液中加入适量的1.0 mol/L NaOH溶液,恰使溶液中的金属离子全部沉淀。下列说法不正确的是
A.该浓硝酸中HN03的物质的量浓度是14.0 mol/L
B.加入NaOH溶液的体积是50 mL
C.浓硝酸在与合金反应中起了酸性和氧化性的双重作用,且起氧化性的硝酸的物质的量为0.08 mol
D.得到的金属氢氧化物的沉淀为3.12克
查看答案和解析>>
科目:高中化学 来源:2016届安徽省合肥市高三上第二次段考化学试卷(解析版) 题型:选择题
下列有关实验原理、方法和结论都正确的是
A.滴加盐酸酸化的BaCl2溶液,生成白色沉淀,原溶液中一定含有SO42-
B.将钾盐溶于盐酸,产生能使澄清石灰水变浑浊的气体,该钾盐一定为K2C03
C.某固体进行焰色反应实验,火焰呈黄色,说明该固体为钠盐
D.向某溶液中滴加KSCN溶液,不变色,再滴加氯水显红色,则溶液中一定含有Fe2+
查看答案和解析>>
科目:高中化学 来源:2016届河南省高三第四次大考化学试卷(解析版) 题型:选择题
某无色溶液中含有H+、Al3+、Mg2+三种阳离子,逐滴加入0.1moL•L﹣1NaOH溶液,消耗NaOH溶液体积(X轴)和生成沉淀(Y轴)之间的函数关系如图所示,则溶液中H+、Al3+、Mg2+三种阳离子的物质的量浓度之比为
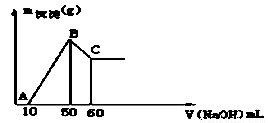
A.1:1:1 B.2:1:1 C.2:2:1 D.1:1:2
查看答案和解析>>
科目:高中化学 来源:2016届河北省衡水市高三复习班上月考化学试卷(解析版) 题型:选择题
进行化学实验时应强化安全意识。下列做法正确的是
A.金属钠着火时使用泡沫灭火器灭火
B.用试管加热碳酸氢钠固体时使试管口竖直向上
C .浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗
D.做蒸馏实验时,如果在沸腾前发现忘记加沸石,应立即停止加热,冷却后补加
查看答案和解析>>
科目:高中化学 来源:2016届广东省粤西“四校”高三上学期第一次联考化学试卷(解析版) 题型:填空题
(12分)硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:
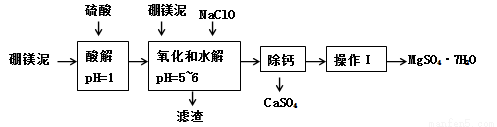
已知:某些氢氧化物沉淀的pH如下表所示:
氢氧化物 | 开始沉淀时的pH | 完全沉淀时的pH |
Mg(OH)2 | 9.3 | 10.8 |
Fe(OH)2 | 7.6 | 9.6 |
Fe(OH)3 | 2.7 | 3.7 |
Al(OH)3 | 3.7 | 4.7 |
根据题意回答第(1)~(6)题:
(1)在酸解过程中,欲加快酸解时的化学反应速率,请提出两种可行的措施:______、_____。
(2)加入的NaClO可与Mn2+反应:Mn2+ + ClO- + H2O = MnO2↓ + 2H+ + Cl-,还有一种离子也会被NaClO氧化,并发生水解,该反应的离子方程式为 。
(3)滤渣的主要成份除含有Fe(OH)3、Al(OH)3 、MnO2外,还有 。
(4)已知MgSO4、CaSO4的溶解度如下表:
温度(℃) | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤是蒸发浓缩, 。“操作I”是将滤液继续蒸发浓缩,冷却结晶, ,便得到了MgSO4·7H2O。
(5)实验中提供的硼镁泥共100 g,得到的MgSO4·7H2O为172.2 g,计算MgSO4·7H2O的产率为 (保留两位有效数字)。
(6)金属镁可用于自然水体中铁件的电化学防腐,完成下图防腐示意图,并作相应标注。
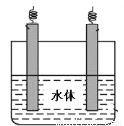
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com