
分析 在原子序数为11~18的元素中,处于第三周期,
(1)同周期自左而右原子半径减小,同主族从上到下原子半径逐渐增大;
(2)元素的金属性越强,对应的最高价氧化物的水化物的碱性越强;
(3)最高正价与最低负价代数和等于4的元素,原子核外最外层电子数为6;
(4)元素的非金属性越强,对应的氢化物的稳定性越强.
解答 解:在原子序数为11~18的元素中,处于第三周期,
(1)同周期自左而右原子半径减小,同主族从上到下原子半径逐渐增大,原子半径最小的元素是H,故答案为:H;
(2)短周期元素的中Na的金属性最强,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,则最高价氧化物的水化物碱性最强的元素是Na,故答案为:Na;
(3)最高正价与最低负价代数和等于4的元素,原子核外最外层电子数为6,应为S,故答案为:S;
(4)元素的非金属性越强,对应的氢化物的稳定性越强,短周期中非金属性最强的为F,对应的HF最稳定,故答案为:F.
点评 本题考查元素位置、结构与性质,为高频考点,侧重于学生的分析能力的考查,把握同周期元素性质的递变规律为解答的关键,题目难度不大.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:推断题
 ,工业上丙可用于氯气管道的泄露,涉及的化学方程式为8NH3+3Cl2=6NH4Cl+N2.
,工业上丙可用于氯气管道的泄露,涉及的化学方程式为8NH3+3Cl2=6NH4Cl+N2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应②中除掉的杂质离子是Fe2+和Mn2+ | |
| B. | 步骤②加高锰酸钾前若PH较低则Fe2+和Mn2+不能除去 | |
| C. | 反应③的类型为置换反应,滤渣中含有锌和镍 | |
| D. | 反应④中的产物成分可能是ZnCO3.xZn(OH)2若得到干燥滤饼22.4克,煅烧后可得到产品16.2克,则X=2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
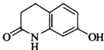 的水解产物互为同分异构体,能与FeCl3溶液发生显色反应,且苯环上的一氯代物只有2种.写出两种满足上述条件的结构简式:
的水解产物互为同分异构体,能与FeCl3溶液发生显色反应,且苯环上的一氯代物只有2种.写出两种满足上述条件的结构简式: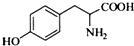 、
、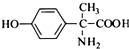 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知:常温下,(1)Ka1(H2CO3)=4.3×10-7,Ka2(H2CO3)=5.6×10-11;(2)H2R及其钠盐的溶液中,H2R、HR-、R2-分别在三者中所占的物质的量分数(α)随溶液pH变化关系如图所示,下列叙述错误的是( )
已知:常温下,(1)Ka1(H2CO3)=4.3×10-7,Ka2(H2CO3)=5.6×10-11;(2)H2R及其钠盐的溶液中,H2R、HR-、R2-分别在三者中所占的物质的量分数(α)随溶液pH变化关系如图所示,下列叙述错误的是( )| A. | 在pH=4.3的溶液中:3c(R2-)=c(Na+)+c(H+)-c(OH-) | |
| B. | 等体积等浓度的NaOH溶液与H2R溶液混合后,溶液中水的电离程度比纯水小 | |
| C. | 在pH=3的溶液中存在$\frac{c({R}^{2-})×c({H}_{2}R)}{c(H{R}^{-})}$=10-3 | |
| D. | 向Na2CO3溶液中加入少量H2R溶液,发生反应:CO32-+H2R=HCO3-+HR- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 置换反应一定都是氧化还原反应 | |
| B. | 化合反应不一定都是氧化还原反应 | |
| C. | 复分解反应一定都不是氧化还原反应 | |
| D. | 氧化还原反应都是置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加入稀盐酸产生无色无味气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32-或HCO3-中的一种或两种 | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| C. | 加入碳酸钠溶液产生白色沉淀,再加盐酸,白色沉淀消失,可能有Ba2+ | |
| D. | 加入硝酸银溶液有白色沉淀生成,则溶液中一定含有Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com