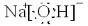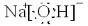(2009?沈阳三模)高铁酸钾(K
2FeO
4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂.其生产工艺如下:

已知:①2KOH+Cl
2→KCl+KClO+H
2O(条件:温度较低)
②6KOH+3Cl
2→5KCl+KClO
3+3H
2O(条件:温度较高)
③2Fe(NO
3)
3+2KClO+10KOH→2K
2FeO
4+6KNO
3+3KCl+5H
2O
回答下列问题:
(1)该生产工艺应在
温度较低
温度较低
(填“温度较高”或“温度较低”)情况下进行;
(2)写出工业上制取Cl
2的化学方程式
;
(3)K
2FeO
4具有强氧化性的原因
K2FeO4中铁元素化合价为+6价,易得电子
K2FeO4中铁元素化合价为+6价,易得电子
;
(4)配制KOH溶液时,是在每100mL水中溶解61.6g KOH固体(该溶液的密度为1.47g/mL),它的物质的量浓度为
10mol/L
10mol/L
;
(5)在“反应液I”中加KOH固体的目的是
AC
AC
:
A.与“反应液I”中过量的Cl
2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供反应物
D.使副产物KClO
3转化为 KClO
(6)从“反应液II”中分离出K
2FeO
4后,会有副产品
KNO3、KCl
KNO3、KCl
(写化学式),它们都是重要的化工产品,具体说出其中一种物质的用途
KNO3可用于化肥,炸药等
KNO3可用于化肥,炸药等
.