
工业利用精炼镁渣(含有MgO、KCl、MgCl2、BaCl2、CaCl2、FeCl3等杂质)回收MgCl2的工业流程如下:
已知:25℃时有关物质的溶度积如下:
| 物质 | CaCO3 | MgCO3 | BaCO3 | Mg(OH)2 | Fe (OH)3 |
| Ksp | 4.96×10-9 | 6.82×10-6 | 5.1×10-9 | 5.61×10-12 | 2.64×10-38 |
(16分)
(1)MgO+2H+=H2O+Mg2+(2分)
(2)溶解时温度太低,反应速率过慢,温度太高, HCl会挥发(3分)
(3)蒸发浓缩,冷却结晶(2分);降低烘干时的温度,防止MgCl2·6H2O分解(3分)
(4) Ba2+(2分);BaCO3溶解度仅小于MgCO3的溶解度,而大于其他物质的溶解度,当Ba2+除尽时,其它杂质已经除尽(2分)
(5)KCl 、NaCl和MgCl2(2分)
解析试题分析:(1)根据镁渣组成及各成分的溶解性可知,加入盐酸的目的是溶解MgO,氧化镁是碱性氧化物,与过量盐酸反应生成氯化镁和水,即MgO+2H+=H2O+Mg2+;(2)溶解温度过低,反应速率太小,温度过高,过量的盐酸易挥发,促进铁离子、镁离子的水解,导致目标产物的生产效率过低;(3)操作I是将过滤所得溶液变为氯化镁的结晶水合物,根据混合物分离提纯方法可知,该操作是蒸发浓缩、冷却结晶、过滤、洗涤、干燥;烘干时温度过高,六水合氯化镁能失去结晶水,因此应降低烘干的温度,防止结晶水化合物分解,所以采取减压烘干;(4)读表中各物质的溶度积可知,溶度积:MgCO3>BaCO3>CaCO3>Mg(OH)2>Fe(OH)3,根据沉淀转化的原理可知,MgCO3(s)+Ba2+ BaCO3(s)+Mg2+,BaCO3(s)+Ca2+
BaCO3(s)+Mg2+,BaCO3(s)+Ca2+ BaCO3(s)+Ba2+,由于目标产物中含有镁离子,因此不能开始沉淀镁离子,只能完全沉淀钙离子、铁离子、钡离子,因为BaCO3溶解度仅小于MgCO3的溶解度,而大于其他物质的溶解度,当Ba2+除尽时,其它杂质已经除尽,因此中和结束前应检验溶液中是否存在Ba2+;(5)过饱和溶液结晶析出之后,母液扔是氯化镁的饱和溶液,此外还有原料中或除杂过程中没有分离的易溶物(如KCl、NaCl),因此母液的主要成分是MgCl2、KCl、NaCl。
BaCO3(s)+Ba2+,由于目标产物中含有镁离子,因此不能开始沉淀镁离子,只能完全沉淀钙离子、铁离子、钡离子,因为BaCO3溶解度仅小于MgCO3的溶解度,而大于其他物质的溶解度,当Ba2+除尽时,其它杂质已经除尽,因此中和结束前应检验溶液中是否存在Ba2+;(5)过饱和溶液结晶析出之后,母液扔是氯化镁的饱和溶液,此外还有原料中或除杂过程中没有分离的易溶物(如KCl、NaCl),因此母液的主要成分是MgCl2、KCl、NaCl。
考点:考查物质制备化学工艺流程,涉及关键步骤的离子方程式及控制温度的原因、混合物分离提纯的方法、解释减压烘干目标产物的原因、利用溶度积及沉淀转化规律解释原因、母液的主要成分的推断等。


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:填空题
高铁酸钠(Na2FeO4)具有很强的氧化性,是一种比氯气更好的净水消毒剂。工业上可以通过次氯酸钠氧化法制备高铁酸钠,生产过程如下,回答下列问题: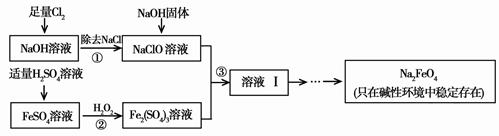
(1)氯气作净水消毒剂是因为它溶于水生成了________,它有强的氧化性,能杀菌消毒。
(2)步骤②反应的离子方程式是 。
(3)从溶液Ⅰ中分离出Na2FeO4后,还有副产品Na2SO4、NaCl,则步骤③中反应的离子方程式为 。
(4)将一定量的Na2FeO4投入到pH不同的污水中(污水中其余成分均相同),溶液中Na2FeO4浓度变化如图曲线Ⅰ、Ⅱ所示,试推测曲线II比曲线I对应的污水pH________(填“高”或“低”)。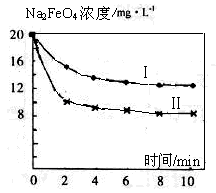
(5)通过计算得知Na2FeO4的消毒效率(以单位质量得到的电子数表示)约是氯气的_____倍
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
用芒硝(Na2SO4 °10H2O)制备纯碱、明矾铵[(NH4)2Al(SO4)2°12H2O]的生产工艺流程如下图:
(1)溶液C中的溶质主要是_____________
(2)明矾铵的溶液呈_____性,明矾铵可用于净水,用离子方程式说明其原理______________________
(3)过程Ⅰ中的反应温度不能超过40℃,其原因是______________________________
(4)运用化学平衡原理解释Na2SO4稍过量的原因
(5)若将Al2(SO4)3加入到A中会产生大量的沉淀和气体,导致明矾铵的产量降低,请用离子方程式解释产生该现象的原因是___________________________________________
(6)溶液E中的溶质离子为__________________
(7)已知明矾铵的溶解度随着温度的升高而增大,过程Ⅱ中得到明矾铵的系列实验操作是: 、 、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上生产高氯酸(沸点:90oC)时还同时生产了亚氯酸钠,其工艺流程如下: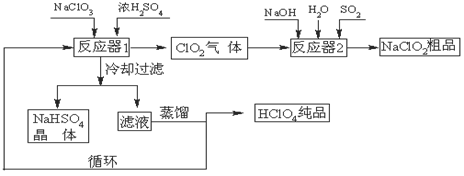
(1)冷却过滤的目的是降低NaHSO4的 ,并分离出NaHSO4晶体。
(2)反应器2中发生反应的离子方程式为 ,SO2的
作用是作 剂。
(3)上述工业生产高氯酸的化学反应为:3NaClO3+3H2SO4(浓)=3NaHSO4+HClO4+2ClO2+H2O,氧化产物与还原产物的物质的量之比为 。
(4)可以通过蒸馏滤液的方法得到高氯酸的原因可能是高氯酸的沸点比较 (填“高”或“低”),容易从溶液中逸出,循环使用的物质是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
一种含铝、锂、钴的电子废料中,铝以铝箔的形式存在,钴以Co3O4的形式存在(吸附在铝箔的单面或双面),锂混杂于其中。从该废料中回收Co3O4的工艺流程如下:
(1)溶液A的溶质的主要成分为 。(填化学式)
(2)钴渣中加入稀H2SO4酸化后,再加入Na2S2O3溶液可以浸出钴离子,则浸出钴离子的离子方程式为(产物中只有一种酸根) 。
(3)在实验室模拟工业生产时,也可用盐酸浸出钴离子,但实际工业生产中不用盐酸,请从反应原理分析不用盐酸浸出钴离子的主要原因: 。
(4)加入NaF的反应为:Li++F- LiF↓,该反应的平衡常数表达式为K= 。
LiF↓,该反应的平衡常数表达式为K= 。
(5)加入30%Na2CO3溶液的作用是 。
(6)在空气中锻烧CoCO3生成Co3O4的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铬酸铅俗称铬黄,不溶于水。广泛用于涂料、油墨、漆布、塑料和文教用品等工业。实验室模拟工业上用铬污泥(含有Cr2O3、Fe2O3、A12O3、SiO2等)制备铬黄的工艺流程如下:
(1)将铬污泥粉碎的目的是 ,操作a的名称为 ;
(2)废渣的主要成分是A1(OH)3和Fe(OH)3。已知25℃时,A1(OH)3的Ksp=1.3×10-33,则该温度下反应Al3++3H2O Al(OH)3+3H+的平衡常数为 (保留两位有效数字);
Al(OH)3+3H+的平衡常数为 (保留两位有效数字);
(3)写出加入30%H2O2过程中发生的离子反应方程式: ;
(4)实验室洗涤铬黄沉淀的方法: ;
(5)写出浓盐酸与A12O3反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某复合材料是以人工碳纤维为增强体、金属钛为基体复合而成的。估计这种材料具有的性质或用途是( )。
①耐高温;②不耐热;③导电、导热;④不导电、不导热;⑤可用于飞机机翼;⑥可用于导弹的壳体
| A.①③⑤⑥ | B.②③⑤⑥ |
| C.②③④ | D.③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列关于工业生产说法错误的是( )
| A.在侯氏制碱工业中,向饱和氯化钠溶液中先通入氨气,后通入二氧化碳 |
| B.在硫酸工业、合成氨工业、硝酸工业中,皆采用循环操作提高原料利用率 |
| C.在氯碱工业,电解槽被离子交换膜隔成阴极室和阳极室 |
| D.工业上采用电解熔融氯化铝的方法制取金属铝 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com