
| ||
| 0.02L |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
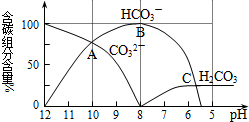
 I����������20mL0.1mol?L-1Na2CO3��Һ����μ���0.1mol?L-1 HCl��Һ40mL����Һ��pH���ͣ���ʱ��Һ�к�̼Ԫ�ص������ʵ���Ũ�ȵİٷֺ��������ᣩҲ�����仯��CO2���ݳ�δ����������ͼ��ʾ���ش��������⣺
I����������20mL0.1mol?L-1Na2CO3��Һ����μ���0.1mol?L-1 HCl��Һ40mL����Һ��pH���ͣ���ʱ��Һ�к�̼Ԫ�ص������ʵ���Ũ�ȵİٷֺ��������ᣩҲ�����仯��CO2���ݳ�δ����������ͼ��ʾ���ش��������⣺c(
| ||
c(
|
 H++HA-����HA-
H++HA-����HA- H++A2-
H++A2-�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 �ں���������ʵ���Һ�У������ж����ѧƽ��森
�ں���������ʵ���Һ�У������ж����ѧƽ��森�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ�꼪��ʡ��ԭ��������ʵ����ѧ�߶���ѧ��12�·��¿���ѧ�Ծ� ���ͣ������
��9�֣���������20mL0.1mol/LNa2CO3��Һ����μ���0.1mol/L HCl��Һ40mL����Һ��pH���ͣ���ʱ��Һ�� ��̼Ԫ�ص������ʵ���Ũ�ȵİٷֺ��������ᣩҲ�����仯��CO2���ݳ�δ������������ͼ��ʾ��
��̼Ԫ�ص������ʵ���Ũ�ȵİٷֺ��������ᣩҲ�����仯��CO2���ݳ�δ������������ͼ��ʾ��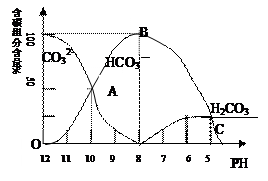
�ش��������⣺
��1������������ʹ��ҺPHΪ10ʱ�����Һ�к�̼Ԫ�ص���������Щ�� ��
��2����д��OAB�ε����ӷ���ʽ �������Һ��PH= ʱ����ʼ�ų�CO2���塣
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ������м���һ�и߶��ڶ����¿���ѧ�Ծ� ���ͣ������
��10�֣��ں���������ʵ���Һ�У������ж����ѧƽ��档
��1�������£���0.2mol/L��ijһԪ��HA��Һ��0.1mol/L NaOH��Һ�������Ϻ���ҺpH����7�������Һ�����������Һ���֮�ͣ�����Һ�����й�ϵ��ȷ����____
A��c(HA)��c(A��) B��c(HA)һ������0.1mol/L
C��c(Na+)��c(HA)+c(A��) D��2c��OH������2c(H+)��[c(HA)��c(A��)]
��2����������20mL0.1mol/L Na2CO3��Һ����μ���0.1mol/L HCl��Һ40mL����Һ�к�̼Ԫ�صĸ�������CO2�ݳ�δ�������ʵ������������ᣩ����ҺpH�仯�IJ��������ͼ��ʾ��
�ش��������⣺
����ͬһ��Һ�У�H2CO3��HCO3����CO32��������ܡ����ܡ��� �������档
�ڵ�pH=7ʱ����Һ�и������������ʵ���Ũ�ȵĴ�С��ϵ�ǣ�
��
����֪��25��ʱ��CO32��ˮ�ⷴӦ��ƽ�ⳣ����ˮ�ⳣ��Kh=  =2��10��4������Һ��c(HCO3��)�Uc(CO32��)=2�U1ʱ����Һ��pH= ��
=2��10��4������Һ��c(HCO3��)�Uc(CO32��)=2�U1ʱ����Һ��pH= ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com