
运用相关化学知识进行判断,下列结论错误的是( )
A.某吸热反应能自发进行,因此该反应是熵增反应
B.NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中
C.可燃冰主要是甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底
D.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率
科目:高中化学 来源: 题型:
LiPF6是锂离子电池中广泛应用的电解质。某工厂用LiF、PCl5为原料,低温反应制备LiPF6,其流程如下:
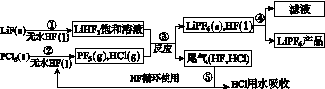
已知:HCl的沸点是-85.0 ℃,HF的沸点是19.5 ℃。
(1)第①步反应中无水HF的作用是________________、________________。反应设备不能用玻璃材质的原因是______________________________________________(用化学方程式表示)。无水HF有腐蚀性和毒性,工厂安全手册提示:如果不小心将HF沾到皮肤上,可立即用2%的________溶液冲洗。
(2)该流程需在无水条件下进行,第③步反应中PF5极易水解,其产物为两种酸,写出PF5水解的化学方程式:____________________________________。
(3)第④步分离采用的方法是________;第⑤步分离尾气中HF、HCl采用的方法是________。
(4)LiPF6产品中通常混有少量LiF。取样品w g,测得Li的物质的量为n mol,则该样品中LiPF6的物质的量为________mol(用含w、n的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向苏打和小苏打溶液中分别加入盐酸 | 均冒气泡 | 两者均能与盐酸反应 |
| B | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3·H2O能大量共存 |
| C | 将可调高度的铜丝伸入到稀HNO3中 | 溶液变蓝 | Cu与稀HNO3发生置换反应 |
| D | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置 | 下层溶液 显紫红色 | 氧化性:Fe3+>I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某气态有机物100mL最多可跟100mL氯化氢发生加成反应,生成氯代烷。每0.5mol的该有机物最多可跟1.5mol Cl2发生取代反应,该有机物结构简式是( )
A.CH≡CH
B.CH2===CH2
C.CH2===CH—CH===CH2
D.CH2===CHCl
查看答案和解析>>
科目:高中化学 来源: 题型:
现有CH4、C2H4、C2H6三种有机化合物:
(1)等质量的以上物质完全燃烧时耗去O2的量最多的是_______。
(2)同状况、同体积的以上三种物质完全燃烧时耗去O2的量最多的是________。
(3)等质量的以上三种物质燃烧时,生成二氧化碳最多的是_____,生成水最多的是________。
(4)在120 ℃、1.01×105 Pa时,有两种气态烃和足量的氧气混合点燃,相同条件下测得反应前后气体体积没有发生变化,这两种气体是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
臭氧是理想的烟气脱硝试剂,其脱硝反应为2NO2(g)+O3(g)  N2O5(g)+O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
N2O5(g)+O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
| A | B |
|
|
|
| 升高温度,平衡常数减小 | 0~3 s内,反应速率为 v(NO2)=0.2 mol·L-1 |
| C | D |
|
|
|
| t1时仅加入催化剂,平衡正向移动 | 达平衡时,仅改变x,则x为c(O2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强。25 ℃时氯气氯水体系中存在以下平衡关系:
Cl2(g) Cl2(aq) K1=10-1.2
Cl2(aq) K1=10-1.2
Cl2(aq)+H2O HClO+H++Cl- K2=10-3.4
HClO+H++Cl- K2=10-3.4
HClO H++ClO- Ka=?
H++ClO- Ka=?
其中Cl2(aq)、HClO和ClO-分别在三者中占分数(α)随pH变化的关系如图所示 。下列表述正确的是( )
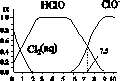
A.Cl2(g)+H2O 2H++ClO-+Cl- K=10-10.9
2H++ClO-+Cl- K=10-10.9
B.在氯处理水体系中,c(HClO)+c(ClO-)=c(H+)-c(OH-)
C.用氯处理饮用水时,pH=7.5时杀菌效果比pH=6.5时差
D.氯处理饮用水时,在夏季的杀菌效果比在冬季好
查看答案和解析>>
科目:高中化学 来源: 题型:
NH3经一系列反应可以得到HNO3和NH4NO3,如下图所示。
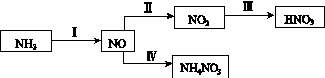
(1)Ⅰ中,NH3和O2在催化剂作用下反应,其化学方程式是_________________________。
(2)Ⅱ中,2NO(g)+O2(g)  2NO2(g)。在其他条件相
2NO2(g)。在其他条件相
同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线(如图)。
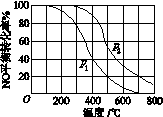
①比较p1、p2的大小关系:________。
②随温度升高,该反应平衡常数变化的趋势是________。
(3)Ⅲ中,降低温度,将NO2(g)转化为N2O4(l),再制备浓硝酸。
①已知:2NO2(g)  N2O4(g) ΔH1 2NO2(g)
N2O4(g) ΔH1 2NO2(g) N2O4(l) ΔH2
N2O4(l) ΔH2
下列能量变化示意图中,正确的是(选填字母)________。
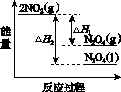
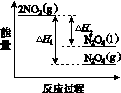
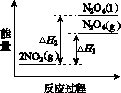
A B C
②N2O4与O2、H2O化合的化学方程式是________________________________________。
(4)Ⅳ中,电解NO制备NH4NO3,其工作原理如图所示。为使电解产物全部转化为NH4NO3,需补充A。A是________,说明理由:________________________________________。
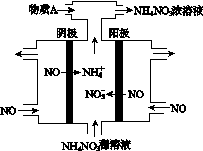
查看答案和解析>>
科目:高中化学 来源: 题型:
乙醇是重要的有机化工原料,可由乙烯气相直接水合法生产或间接水合法生产。回答下列问题:
(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H),再水解生成乙醇。写出相应反应的化学方程式:________________________________________。
(2)已知:
甲醇的脱水反应
2CH3OH(g)===CH3OCH3(g)+H2O(g)
ΔH1=-23.9 kJ·mol-1
甲醇制烯烃的反应
2CH3OH(g)===C2H4(g)+2H2O(g)
ΔH2=-29.1 kJ·mol-1
乙醇的异构化反应 C2H5OH(g)===CH3OCH3(g)
ΔH3=+50.7 kJ·mol-1
则乙烯气相直接水合反应C2H4(g)+H2O(g)===C2H5OH(g)的ΔH________kJ·mol-1。与间接水合法相比,气相直接水合法的优点是____________________________________。
(3)如图所示为气相直接水合法中乙烯的平衡转化率与温度、压强的关系[其中n(H2O)∶n(C2H4)=1∶1]。
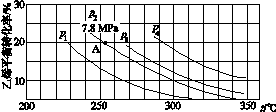
①列式计算乙烯水合制乙醇反应在图中A点的平衡常数Kp=____________________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
②图中压强(p1、p2、p3、p4)的大小顺序为____,理由是___________________。
③气相直接水合法常采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度290 ℃、压强6.9 MPa,n(H2O)∶n(C2H4)=0.6∶1。乙烯的转化率为5%,若要进一步提高乙烯转化率,除了可以适当改变反应温度和压强外,还可采取的措施有________________________________________________________________________、
________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com