
| A. | 电解饱和食盐水或熔融氯化钠时,阳极的电极反应式均为2Cl--2e-═Cl2↑ | |
| B. | 钢铁发生吸氧腐蚀和析氢腐蚀的负极反应式均为Fe-2e-═Fe2+ | |
| C. | 精炼铜和电镀铜时,与电源负极相连的电极反应式均为Cu2++2e-═Cu | |
| D. | 酸性介质或碱性介质的氢氧燃料电池的正极反应式均为O2+2H2O+4e-═4OH- |
分析 A.氯离子的放电能力大于氢氧根离子;
B.钢铁的析氢腐蚀和吸氧腐蚀中负极电极反应式相同,都是铁失电子发生氧化反应;
C.电解精炼铜或电镀铜时,阴极上铜离子得电子发生还原反应;
D.酸性介质中,氢氧燃料电池中正极上生成水,碱性介质中,氢氧燃料电池中正极上生成氢氧根离子.
解答 解:A.氯离子的放电能力大于氢氧根离子,所以用惰性电极电解饱和食盐水或熔融氯化钠时,阳极上都是氯离子放电生成氯气,电极反应式为2Cl--2e-═Cl2↑,故A正确;
B.钢铁的析氢腐蚀和吸氧腐蚀中负极电极反应式相同,都是铁失电子发生氧化反应,电极反应式为Fe-2e-═Fe2+,故B正确;
C.电解精炼铜或电镀铜时,阴极上铜离子得电子发生还原反应,电极反应式为Cu2++2e-═Cu,故C正确;
D.酸性介质中,氢氧燃料电池中正极上生成水,电极反应式为O2+4H++4e-═2H2O,碱性介质中,氢氧燃料电池中正极上生成氢氧根离子,电极反应式为O2+2H2O+4e-═4OH-,故D错误;
故选D.
点评 本题考查了原电池和电解池原理,明确电极上发生的反应是解本题关键,难点的电极反应式的书写,易错选项是B,注意电解质溶液不同,电极反应式可能不同,为易错点.


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:实验题
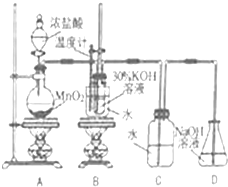 某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验.
某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验.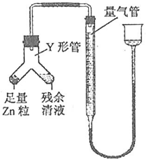 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
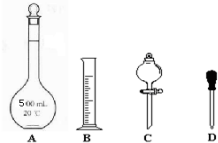
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醛的结构简式:CH3COH | |
| B. | 乙烯的比例模型: | |
| C. | S2-的结构示意图: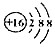 | |
| D. | 含中子数为10的氧元素的一种核素${\;}_{8}^{18}$O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1molSO3的气体体积为22.4L | |
| B. | 1mol铁粉与过量Cl2反应时,转移电子数为2NA | |
| C. | 含有2NA个氧原子的D2O质量为40g | |
| D. | 16gO2分子中含有的氧原子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1L庚烷完全燃烧所生成的气态产物的分子数为$\frac{7}{22.4}$NA | |
| B. | 1 mol甲基(-CH3)所含的电子总数为9NA | |
| C. | 0.5 mol1,3-丁二烯分子中含有C=C双键数为 NA | |
| D. | 28g乙烯所含共用电子对数目为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源:2017届云南省高三上第二次周考化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A.NH4HCO3溶液与过量NaOH溶液反应:NH4++OH―=NH3↑+H2O
B.用惰性电极电解饱和氯化钠溶液:2Cl―+2H+ H2↑+Cl2↑
H2↑+Cl2↑
C.向Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I―=2Fe2++I2
D.Na2SO3溶液使酸性KMnO4溶液褪色:5SO32―+6H++2MnO4―=5SO42―+2Mn2++3H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com