
����Ŀ��ij���ʳ�������ˮ�еĵ�Ԫ�ض���![]() ��NH3H2O����ʽ���ڣ��÷�ˮ�Ĵ���������ͼ��
��NH3H2O����ʽ���ڣ��÷�ˮ�Ĵ���������ͼ��

��1��������������NaOH��Һ������pH��9��������30�� C��ͨ���������ϳ������ա�
�����ӷ���ʽ��ʾ��NaOH��Һ�����ã�__________________��
��2����������������������£�![]() ����������Ӧ��������
����������Ӧ��������![]() ��������Ӧ�������仯��ͼ��ʾ��
��������Ӧ�������仯��ͼ��ʾ��

����һ����Ӧ��________��Ӧ(����ȡ������ȡ�)���ж�����______________________��
��1 mol NH4+(aq)ȫ����������NO3(aq)���Ȼ�ѧ����ʽ��______________________________��
��3����������һ�������£����ˮ�м���CH3OH����HNO3��ԭ��N2�����÷�Ӧ����32 g CH3OH��ת��6 mol���ӣ���μӷ�Ӧ�Ļ�ԭ���������������ʵ���֮����__________��
���𰸡���1��![]() +OH
+OH![]() NH3��H2O
NH3��H2O
��2�������� ��H =273 kJ/mol��0(��Ӧ��������������������������)
��![]() (aq)+2O2(g)
(aq)+2O2(g)![]() 2H+(aq)+
2H+(aq)+ ![]() (aq)+H2O(l) ��H=346 kJ��mol1
(aq)+H2O(l) ��H=346 kJ��mol1
��3��5��6
����������1������NaOH��Һ������pH��9������ӦNH4++OH![]() NH3��H2O��
NH3��H2O��
��2������ͼ��֪��һ����Ӧ����Ӧ�������֮�ʹ��������������֮�ͣ�����Ƿ��ȷ�Ӧ��
��![]() (aq)+1.5O2(g)
(aq)+1.5O2(g)![]() NO2(aq)+2H+(aq)+H2O(l) ��H =273kJ/mol����NO2(aq)+0.5O2(g)
NO2(aq)+2H+(aq)+H2O(l) ��H =273kJ/mol����NO2(aq)+0.5O2(g)![]()
![]() (aq) ��H =73kJ/mol������+���ã�NH4+(aq)+2O2(g)
(aq) ��H =73kJ/mol������+���ã�NH4+(aq)+2O2(g)![]() 2H+(aq)+
2H+(aq)+ ![]() (aq)+H2O(l) ��H =346kJ/mol��
(aq)+H2O(l) ��H =346kJ/mol��
��3��CH3OH��������CO2��CԪ�ػ��ϼ۴�2�����ߵ�+4�ۣ�����6��HNO3����ԭ��N2��NԪ�ػ��ϼ۴�+5�۽��͵�0�ۣ�����5�����ݵ��ӵ�ʧ�غ�(���ϼ��������)�ɵû�ԭ��CH3OH��������HNO3�����ʵ���֮����5��6��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������1807�껯ѧ�Ҵ�ά�õ���������������Ƶ��ƣ���Ӧԭ��Ϊ��4NaOH��������=4Na+O2��+2H2O���������� ����������������������������Ҳ�Ƶ��ƣ���Ӧԭ��Ϊ��3Fe+4NaOH=Fe3O4+2H2��+4Na���������й�˵����ȷ������ ��
A��������������������ƣ����������缫��ӦΪ��Na++e-=Na
B�����������˷�����ԭ�����������Ļ�ԭ�Ա���ǿ
C������ά������������˷��Ƶõ������ƣ�������Ӧ��ת�Ƶĵ���������Ϊ2:l
D��Ŀǰ��ҵ�ϳ��õ�������Ȼ��Ʒ���������ͼ����������ʯī��Ϊ��������Ϊ����
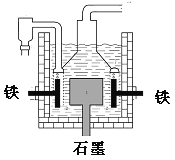
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����34.2g Al2(SO4)3 ��������ˮ���100mL��Һ��
��1��д��Al2(SO4)3��ˮ��Һ�еĵ��뷽��ʽ��__________________________________��
��2������Һ��Al2(SO4)3�����ʵ���Ũ��Ϊ________________________��
��3���Ӹ���Һ��ȡ��10mL������SO42�� �����ʵ���Ũ��Ϊ____________________��
��4���Ӹ���Һ��ȡ��10mL��ϡ�͵�100mL��ϡ�ͺ���Һ������Al2(SO4)3�����ʵ���Ũ��Ϊ________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����е������������ã���Ӧ������Ӧ��������ı�ʱ����������û��Ӱ�����
A. NaOH�� CO2 B. Na2O2 ��CO2 C. NaOH��AlCl3 D. Na��O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�����A��B��C�ֱ�Ϊ����ɫ���塢����ɫ���塢��ɫ���壬��A�ڿ�����ȼ�ջ��ɵ���ɫ��ĩ����һ�������£����ǿ��Է�����ͼ��ʾ��ת����ϵ����E��Һ����ɫ�ģ����ͼ�ش�

��1��д���������ʵĻ�ѧʽ��A______��B______��C_____��
��2��д�����з�Ӧ�Ļ�ѧ����ʽ��
��Ӧ��________________________
��Ӧ��________________________
��Ӧ��________________________
��3��ʵ�����б�����������A�ķ�����______���ش�A��һ����;______________��A�ڿ�����ȼ�������ò�������Ԫ�صĻ��ϼ���______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������������ԡ���̼����������������ǣ�������
A. ��������У�������־���ʹ��һ���Բ;�
B. ������ź��Ӵ��յ�
C. �������صġ�������ʳ�����ʳ��ļӹ�����
D. ���Ŵ������ļ���������ֱ��������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ش��������⣺
��1��������NaHSO4��Ba(OH)2����Һ�а������ʵ���֮��2��1��ϣ����ӷ���ʽΪ________����ʱ��Һ��________�ԡ�
������NaHSO4��Ba(OH)2����Һ�а������ʵ���֮��1��1��ϣ����ӷ���ʽΪ________����ʱ��Һ��________�ԡ�
��2���������ܽ���˳�ȥ���������ʺ�����Һ�����εμӹ���NaOH��Һ��BaCl2��Һ��Na2CO3��Һ��ֱ�����ٲ�����������Щ������Ŀ����________���μ�Na2CO3��Һʱ������Ӧ�Ļ�ѧ����ʽΪ___________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����ӷ���ʽ�У���ȷ����(����)
A. ϡ�������ͭƬ�ϣ�Cu��2H��===Cu2����H2��
B. ϡ������Ba(OH)2��Һ��ϣ�SO![]() ��Ba2��===BaSO4��
��Ba2��===BaSO4��
C. ϡ������ڴ���ʯ�ϣ�CaCO3��2H��===Ca2����H2CO3
D. ��������ϡ�����ϣ�Fe2O3��6H��===2Fe3����3H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������������ӻ������Һ��й��ۼ�����
A. N2 B. MgCl2 C. HCl D. KOH
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com