(2010?广州一模)二甲醚(CH
3OCH
3)在未来可能替代柴油和液化气作为洁净液体燃料使用.
工业上以C0和H
2为原料生产CH
30CH
3的新工艺主要发生三个反应:
①CO( g)+2H
2(g)?CH
3OH( g)△H
1=-91KJ?mol
-1②2CH
30H(g)?CH
30CH
3(g)+H
20(g)△H
2=-24KJ?mol
-1③CO(g)+H
2O(g)?CO
2(g)+H
2(g)△H
3=-41KJ?mol
-1回答下列问题:
(1)新工艺的总反应为:3CO(g)+3H
2(g)?CH
3OCH
3(g)+CO
2(g)△H该反应△H=
-247KJ?mol-1
-247KJ?mol-1
,平衡常数表达式K=
| c(CH3OCH3)?c(CO2) |
| c3(CO)?c3(H2) |
| c(CH3OCH3)?c(CO2) |
| c3(CO)?c3(H2) |
(2)增大压强,CH
30CH
3的产率
增大
增大
(填“增大”、“减小”或“不变”).
(3)原工艺中反应①和反应②分别在不同的反应器中进行,无反应③发生.新工艺中反应③的发生提高了CH
30CH
3的产率,原因是
反应③消耗了反应②中的产物H2O,使反应②的化学平衡向正反应方向移动,从而提高CH3OCH3的产率
反应③消耗了反应②中的产物H2O,使反应②的化学平衡向正反应方向移动,从而提高CH3OCH3的产率
.
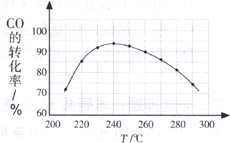
(4)为了寻找合适的反应温度,研究者进行了一系列试验,每次试验保持原料气组成、压强、反应时间等因素不变,试验结果如图.CO转化率随温度变化的规律是
温度低于240℃时,CO的转化率随着温度的升高而增大;温度高于240℃时,CO的转化率随着温度的升高而减小
温度低于240℃时,CO的转化率随着温度的升高而增大;温度高于240℃时,CO的转化率随着温度的升高而减小
,其原因是
在较低温时,各反应体系均未达到平衡,CO的转化率主要受反应速率影响,随着温度的升高反应速率增大,CO的转化率也增大;在较高温时,各反应体系均已达到平衡,CO的转化率主要受反应限度影响,随着温度的升高平衡向逆反应方向移动,CO的转化率减小
在较低温时,各反应体系均未达到平衡,CO的转化率主要受反应速率影响,随着温度的升高反应速率增大,CO的转化率也增大;在较高温时,各反应体系均已达到平衡,CO的转化率主要受反应限度影响,随着温度的升高平衡向逆反应方向移动,CO的转化率减小
.

 (2010?广州一模)二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用.
(2010?广州一模)二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用.

 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案