(2013?济南二模)纯碱(Na
2CO
3)在生产生活中具有广泛的用途.图1是实验室模拟制碱原理制取Na
2CO
3的流程图.
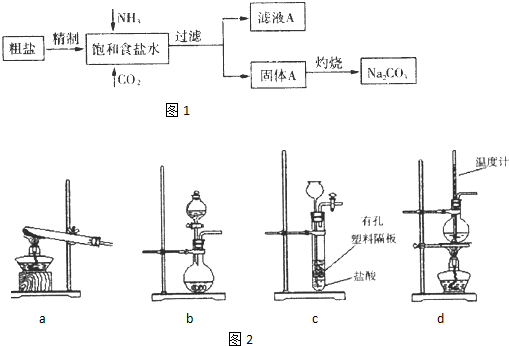
已知:向饱和食盐水中通入NH
3、CO
2后发生和反应为NaCl+NH
3+CO
2+H
2O→NaHCO
3↓+NH
4Cl,请回答以下问题:
(1)粗盐中含有的杂质离子有Ca
2+,Mg
2+,SO
42-等.
精制除杂的步骤顺序a→
c
c
→
d
d
→
e
e
→b(填字母编号).
a.粗盐溶解,滤去沉渣.b.加入盐酸调pH;c.加入Ba(OH)
2溶液;d.加入Na
2CO
3溶液;e.过滤
向饱和食盐水中先通入NH
3,后通入CO
2,理由是
NH3易溶于水,有利于吸收溶解度不大的CO2
NH3易溶于水,有利于吸收溶解度不大的CO2
.
(2)灼烧固体A制Na
2CO
3在
a
a
(填字母序号)中进行.
a.坩埚 b.蒸发皿 c.烧杯 d.锥形瓶
证明滤液A中含有NH
4+的方法是
取少量滤液A于试管中,加入足量NaOH溶液并加热,产生能使湿润的红色石蕊试纸变蓝色的气体,证明A中含有NH4+
取少量滤液A于试管中,加入足量NaOH溶液并加热,产生能使湿润的红色石蕊试纸变蓝色的气体,证明A中含有NH4+
.
对滤液A进行重结晶能够获得NH
4HCO
3,向pH=13含Na
+、K
+的溶液中加入少量NH
4HCO
3.使pH降低,反应的离子方程式
NH4++HCO3-+2OH-=NH3?H2O+CO32-+H2O
NH4++HCO3-+2OH-=NH3?H2O+CO32-+H2O
.
(3)图2装置中常用于实验室制备CO
2的是
bc
bc
(填字母编号);用b示意的装置制备NH
3,分液漏斗中盛放的试剂
浓氨水
浓氨水
(填试剂名称),烧瓶内可加入的固体试剂
生石灰(或NaOH固体)
生石灰(或NaOH固体)
(填试剂名称).
(4)一种天然碱晶体成分是aNa
2CO
3?bNa
2CO
3?cH
2O,某同学利用下列提供的试剂,设计了如下简单合理测定Na
2CO
3的质量分数的实骏方案.(仪器自选)请把实验方案填全:供选择的试剂:1mol?L
-1H
2SO
4溶液、1.0mol?L
-1BaCl
2溶液、稀氨水、碱石灰、Ca(OH)
2溶液、蒸馏水.
①称取m
1g一定量天然碱晶体样品,溶于适量蒸馏水中.
②
加入足量稀硫酸并微热,产生的气体通过足量的澄清石灰水
加入足量稀硫酸并微热,产生的气体通过足量的澄清石灰水
.
③
过滤、洗涤、干燥、称量沉淀
过滤、洗涤、干燥、称量沉淀
.
④计算天然碱晶体中含Na
2CO
3的质量分数.



 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案