
| A. |  根据图可判断可逆反应“A2(g)+3B2(g)?2AB3(g)”的△H<0 | |
| B. |  如图表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(s)的影响,乙的压强大 | |
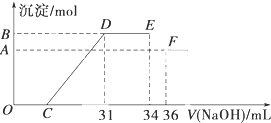
| C. |  如图可表示醋酸溶液中通入氨气至过量过程中溶液导电性的变化 | |
| D. |  如图④是N2与H2合成氨的能量变化曲线,可确定该反应1mol N2和4molH2充分反应时放热一定等于92kJ |
分析 A、从温度升高正逆反应速率的变化判断平衡移动的方向,以此来判断反应热问题;
B、从压强对反应速率的影响结合图象中曲线斜率的大小判断压强大小,根据压强对平衡移动的影响判断反应物含量的变化;
C、从溶液中离子浓度的变化判断导电性问题;
D、反应是可逆反应不能进行彻.
解答 解:A、根据图象可知,温度升高,逆反应速率大于正反应速率,平衡向逆反应方向移动,则正反应为放热反应,△H<0,故A正确;
B、从图象可知,乙曲线斜率大,乙反应到达平衡用得时间少,则乙反应速率快,根据压强对反应速率的影响,压强越大反应速率越大,则乙曲线压强大,根据反应方程式可以看出,物质D为固体,则增大压强平衡向正反应方向移动,反应物的含量减小,而图中达到平衡时反应物的浓度在两种不同压强下相同,是不符合实际的,故B错误;
C、乙酸和氨水都为弱电解质,二者反应生成醋酸铵为强电解质,溶液中离子浓度增大,导电性增强,故C错误;
D、由图象可知反应热为△H=-92 KJ/mol,合成氨的反应为可逆反应,则反应1 mol N2和4 mol H2充分反应时放热一定小于92 KJ,故D错误;
故选A.
点评 本题为图象题,做题时注意分析图象题中曲线的变化特点是做该类题型的关键,掌握反应特征,平衡移动原理,影响反应速率和平衡移动的因素分析是解题关键,本题难度中等,


 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究性学习小组对铝热反应实验展开研究.现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3的熔点、沸点数据如下:
某研究性学习小组对铝热反应实验展开研究.现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3的熔点、沸点数据如下:| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | - |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 切开的金属Na暴露在空气中,光亮表面逐渐变暗:2Na+O2═Na2O2 | |
| B. | 电解饱和食盐水:2NaCl$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑ | |
| C. | Na2O2在潮湿空气中放置一段时间,变成白色黏稠物:2Na2O2+2CO2═2Na2CO3+O2 | |
| D. | 向NaHCO3溶液中加入少量的澄清石灰水,出现白色沉淀:2HCO${\;}_{3}^{-}$+Ca2++2OH-═CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中Na2O2既是氧化剂又是还原剂,O2是还原产物 | |
| B. | 若Fe2+失去4mol电子,生成氧气的体积约为22.4L | |
| C. | 4 mol Na2O2在反应中共得到6NA个电子 | |
| D. | 反应过程中可以看到白色沉淀先转化为灰绿色后转化为红褐色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、NO、SiO2都是酸性氧化物 | |
| B. | PM2.5是指大气中直径接近于2.5xl0 -6m的颗粒物,它在空气中形成气溶胶 | |
| C. | 向蛋白质溶液中滴加CuS04溶液产生沉淀属于化学变化 | |
| D. | KCl和SO3溶于水后均能导电,是因为KC1和S03都为电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用氧化物形式表示为BaO•CuO•2SiO2 | |
| B. | 性质稳定,不易脱色 | |
| C. | 易溶解于强酸和强碱 | |
| D. | x等于6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com