
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 无色透明溶液中: Zn2+、SO42-、NH4+,Cl-
B. 0.1mol/L NaHCO3溶液中: Mg2+、Al3+、K+、NO3-
C. 能使甲基橙变黄的溶液中: Na+,CH3COO-、 MnO4-、 Fe3+
D. c(H+)/c(OH-)=1×1012的溶液中:NO3-、I-、K+、Fe2+
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:

下列叙述正确的是( )
A. 试剂X可以是硫酸
B. 反应①过滤后所得沉淀1为氧化铁
C. 图中所示转化中:Al2O3→Al可选用热分解法
D. 反应②的离子方程式为2AlO2 - + CO2 + 3H2O = 2Al(OH)3↓+ CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸镧[La2(CO3)3]可用于治疗终末期肾病患者的高磷酸盐血症。制备反应原理为:LaC13+6NH4HCO3= La2(CO3)3↓+6NH4Cl+ 3CO2↑+3H2O;某化学兴趣小组利用下列装置实验室中模拟制备碳酸镧。

(l)盛放稀盐酸的仪器为____________。
(2)制备碳酸镧实验流程中导管从左向右的连接顺序为:F→___→___ →___ →___ →___ 。
(3)Y中发生反应的化学反应式为________________。
(4)X中盛放的试剂是_____,其作用为________________。
(5)Z中应先通入NH3,后通入过量的CO2,原因为_________。
(6)La2(CO3)3质量分数的测定:准确称取10.0g产品试样,溶于10.0mL稀盐酸中,加入10 mLNH3 —NH4Cl缓冲溶液,加入0.2g紫脲酸铵混合指示剂,用0.5mol/LEDTA(Na2H2Y)标准溶液滴定至呈蓝紫色(La3++H2Y-=LaY-+2H+),消耗EDTA 溶液44.0 mL。则产品中La2(CO3)3的质量分数ω[La2(CO3)3]=_________。
(7)该化学兴趣小组为探究La2(CO3)3和La(HCO3)3的稳定性强弱,设计了如下的实验装置,则甲试管中盛放的物质为_______;实验过程中,发现乙试管中固体质量与灼烧时间的关系曲线如图所示,试描述实验过程中观察到的现象为______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅及其化合物在材料领域中应用广泛。下列叙述不正确的是
A. 硅单质可用来制造太阳能电池
B. 硅单质是制造玻璃的主要原料
C. 石英(SiO2)可用来制作工艺品
D. 二氧化硅是制造光导纤维的材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化钛是乙烯聚合催化剂的重要成分,制备反应如下:
①TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g) △H1=+175.4KJ/mol
②C(s)+1/2O2(g)=CO(g) △H2=-110.45 KJ/mol,下列说法正确的是

A. C的燃烧热为110.45KJ/mol
B. 反应①若使用催化剂,△Hl会变小
C. 反应①中的能量变化如图所示
D. 反应TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g) △H=-45.5KJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨化法是合成硫酰氯(SO2Cl2)的常用方法,实验室合成的酰氯的反应和实验装置如下所示:SO2(g)+Cl2(g) ![]() SO2Cl2(1) ΔH=-97.3KJ/mol。
SO2Cl2(1) ΔH=-97.3KJ/mol。

已知: 一般条件下,硫酰氯为无色气体,熔点为-541℃,沸点为69.1℃,在潮湿空气中会“发烟”;100℃以上开始分解,生成二氧化硫和氧气,长期放置会分解。
请回答下列问题:
(1)装置甲中,70%的硫酸体现的性质为_________。
(2)仪器己中盛放的试剂主要用于排气,该试剂最合适的是______(填名称);实验时,从仪器己中放出该试剂的操作方法是_________。
(3)①装置庚中的药品最合适的是________(填字母);
a.五氧化二磷 b. 碱石灰 c.无水氯化钙 d.硅胶
②装置丙的冷凝管中出水口是_______(填标号)
(4)活性炭的作用是____;若缺少装置乙和丁(均盛放浓硫酸),潮湿的氯气和二氧化硫发生反应的化学方程式是________。
(5)为提高本实验的硫酰氯的产率,在实验操作中还需要注意的有______。
a.控制气流速度,宜慢不宜快
b.保证装置的气密性良好
c.先向装置丙中通入一种气体,排出空气后再通入另一种气体
d.先通气体,再通冷凝水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知液氨的性质与水相似,25℃时,NH3+NH3NH ![]() +NH
+NH ![]() ,NH
,NH ![]() 的平衡浓度为1×10﹣15molL﹣1 , 则下列说法中正确的是( )
的平衡浓度为1×10﹣15molL﹣1 , 则下列说法中正确的是( )
A.在液氨中加入NaNH2可使液氨的离子积变大
B.在液氨中加入NH4Cl可使液氨的离子积减小
C.在此温度下液氨的离子积为1×10﹣17
D.在液氨中放入金属钠,可生成NaNH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,回答下列有关问题: 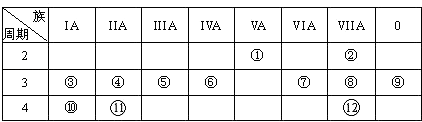
(1)写出下列元素符号:① , ⑥ , ⑦ .
(2)画出原子的结构示意图:④ , ⑧ .
(3)在①~12元素中,金属性最强的元素是 , 非金属性最强的元素是 , 最不活泼的元素是 . (均填元素符号)
(4)元素⑦与元素⑧相比,非金属性较强的是(用元素符号表示),下列表述中能证明这一事实的是 .
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
(5)第三周期中原子半径最大的元素是(填序号),跟它同周期原子半径最小的元素是(填序号),它们可以形成(填离子或共价)化合物,用电子式表示其形成过程如下: .
(6)已知某元素原子最外层电子数是其次外层电子数的2倍,该元素可以与⑧形成一种AB4型的化合物,请用电子式表示其形成过程: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在pH = 14的溶液中,下列离子能大量共存的是
A. Na+、Al3+ 、NO3-、Cl- B. Na+、SO4 2-、Cl- 、NH4+
C. K+、Cl-、Na+、HCO3- D. S2-、NO3-、Na+、K+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com