
在FeCl3和CuCl2的混合溶液中加入过量的铁粉,若充分反应后溶液的质量没有变化,则原混合溶液中Fe3+和Cu2+的物质的量浓度之比为( )
A.2∶7 B.1∶7 C.7∶1 D.5∶14
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
花青苷是引起花果呈现颜色的一种花色素, 广泛存在于植物中。它的主要结构在不同pH条件下有以下存在形式:


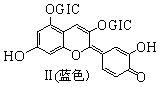 (GIC——葡萄糖基)
(GIC——葡萄糖基)
下列有关花青苷说法不正确的是 :
A.花青苷可作为一种酸碱指示剂 B.I和II中均含有二个苯环
C.I和II中除了葡萄糖基外,所有碳原子可能共平面
D.I和II均能与FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
元素W、X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4,M原子的最外层电子数与次外层电子数之比为3∶4,且M原子的质子数是Y原子的2倍;X元素的最高正价与最低负价绝对值之差为2;N-、Z+、W+的半径逐渐减小;化合物WN常温下为气体,据此回答下列问题:
(1)W与Y可分别形成10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式:_________________________________________。
(2)下图表示由上述两种元素组成的气体分子在一定条件下的密闭容器中充分反应前后的转化关系,请写出该转化过程的化学方程式:_________________。

(3)A、B均为由上述六种元素中的三种元素组成的强电解质,且组成元素的原子个数之比均为1∶1∶1。若在各自的水溶液中,A能抑制水的电离,B能促进水的电离,则A的化学式为________,B的电子式是________。
(4)XY2与H2O反应的离子方程式为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
一种新型净水剂PAFC{聚合氯化铁铝[AlFe(OH)nCl6-n]m,n<5,m<10},广泛用于生活用水的净化和废水的净化,有关PAFC的说法正确的是( )
A.PAFC用于净化饮用水时,可以除去水中所有的有害物质
B.PAFC中铁显+2价
C.PAFC可看作一定比例的氯化铝和氯化铁的水解产物
D.FAFC在强酸性或强碱性溶液中都能稳定存在
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组的同学欲测定该补血剂中铁元素的含量。实验步骤如下:
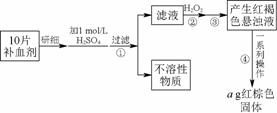
图95
请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是:取样,先滴加KSCN溶液,再滴加____________,该过程的现象为________________________。
(2)步骤②加入过量H2O2的目的是________________________________________________________________________
________________________________________________________________________。
(3)步骤③中反应的离子方程式是________________________________________________________________________
________________________________________________________________________。
(4)步骤④中一系列处理的操作步骤:过滤、________________________________________________________________________、
灼烧、________、称量。
(5)若实验中铁无损耗,则每片补血剂中含铁元素的质量为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
学生用铝片分别和稀盐酸、稀硫酸反应发现:铝片与稀盐酸反应现象非常明显,而和稀硫酸几乎不反应。为排除因试剂变质等因素造成的影响,该学生在教师的指导下重新进行下列实验,验证是否存在上述现象。
铝与酸反应的情况。结果如下:
反应进程(分钟) 1 2 5 15 20
3.0mol/L盐酸 少量气泡 较多气泡 大量气泡 反应剧烈 铝片耗尽
1.5mol/L硫酸 均无明显现象(无气泡产生)
3.0mol/L硫酸 均无明显现象(无气泡产生)
通过上述实验可知,无论是用1.5mol/L 硫酸还是3.0mol/L 硫酸,均无明显的现象,而3.0mol/L盐酸与铝片反应的现象却十分明显。
(1)反应1~15min 内,铝与盐酸的反应速率逐渐加快,其主要原因是
__________________________ 。
(2)根据以上探究“铝与稀盐酸和稀硫酸反应差异的原因”,你能对问题原因作出哪些假设或猜想(列出两种即可)?
假设一:_________________________________________________________________
假设二:_________________________________________________________________
(3)通过你的思考,教材中H2O2的分解所用的催化剂(FeCl3和CuSO4)这个实验(关于催化剂对化学反应速率的影响)也需要改进,才具有说服力,应怎样改进
________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com