
【题目】将30mL 0.5molL-1 NaOH溶液加水稀释到500mL,稀释后的溶液中NaOH的物质的量浓度为
A. 0.3 molL-1 B. 0.05 molL-1 C. 0.03 molL-1 D. 0.02 molL-1
科目:高中化学 来源: 题型:
【题目】已知X、Y中含有相同的元素,Z、W中也含有相同的元素,根据反应X+H2O→Y+H2↑;Z+H2O→W+O2↑(方程式均未配平),可推断X、Y中及Z、W中相同元素的化合价的高低顺序为 ( )
A. X>Y,Z>W B. X<Y,Z<W
C. X>Y,Z<W D. X<Y,Z>W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A和B,混合于2 L的密闭容器中,发生如下反应:3A(g)+B(g) === xC(g)+2D(g);5 min后测得c(D)=0.5 mol·L-1,c(A)∶c(B)=3∶5,C的反应速率是0.1 mol·L-1·min-1。
(1)A在5 min末的浓度是____________;
(2)v(B)=____________;
(3)x=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知气态烃A的密度是相同状况下氢气密度的14倍,有机物A~E能发生如图所示一系列变化,则下列说法错误的是

A. A分子中所有原子均在同一平面内
B. A→B所用试剂为![]()
C. 分子式为![]() 的酯有3种
的酯有3种
D. 等物质的量的B、D分别与足量钠反应生成气体的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中没有用到玻璃棒的是( )
A.配制100mL0.2molL-1NaOH溶液
B.食盐的精制
C.浓硫酸的稀释
D.Fe(OH)3胶体的制备
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸锂广泛应用于化工、冶金等行业。工业上利用锂辉石(Li2Al2Si4Ox)制备碳酸锂的流程如下:
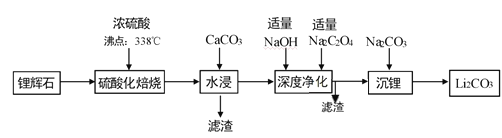
已知:①CaC2O4难溶于水;②Li2CO3的溶解度(g/L)。
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
Li2CO3 | 1.54 | 1.43 | 1.33 | 1.25 | 1.17 | 1.08 | 1.01 | 0.85 | 0.72 |
请回答下列问题:
(1)锂辉石(Li2Al2Si4Ox)可以用氧化物的形式表示其组成,形式为___________。
(2)“深度净化”时,加入适量Na2C2O4的目的是__________________。
(3)“沉锂”需要在95℃以上进行,主要原因是_____________________。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下:
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH 溶液做阴极液,两者用离子选择透过膜隔开,用惰性电极电解。
b.电解后向LiOH溶液中加入少量NH4HCO3溶液并共热,过滤、烘干得高纯Li2CO3。
①a中,阳极的电极反应式是__________________,宜选用_________(“阳”或“阴”)离子交换膜。
②b中,生成Li2CO3反应的化学方程式是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中充入一定量NO2,发生反应2NO2(g) ![]() N2O4(g) ΔH=-57 kJ· mol-1。在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是
N2O4(g) ΔH=-57 kJ· mol-1。在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是
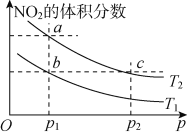
A. a、c两点的反应速率:a>c
B. a、b两点NO2的转化率:a<b
C. a、c两点气体的颜色:a深,c浅
D. 由a点到b点,可以用加热的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 稳定性:HCl<HBr
B. 氯化钠和冰熔化时,化学键都被破坏
C. H2O2是既含极性键又含非极性键的共价化合物
D. NaOH、NH4Cl、H2SO4在水中均能电离出离子,它们都是离子化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com