
(12分)金属单质及其化合物在生产生活中应用非常广泛,废旧金属的回收利用是重要研究课题。某学习小组在实验室中模拟利用含铜废料(主要成分为Cu和CuO,还有少量的A1,Fe及其氧化物)生产胆矾,其实验方案如下:

(1)上述流程中,操作1所得“滤液’‘的主要成分为_____________;
(2)酸溶后所得溶液中的榕质主要有_____________;
(3)请写出酸溶过程单质铜发生反应的离子方程式___________;该反应中氧化剂与还原剂的物质的量之比为______________;
(4)试剂可以是________________;
(5)操作3是一系列操作.其操作为______________、冷却结晶、过滤、___________、小心干燥。
(1)NaAlO2 (2)CuSO4、Fe2(SO4)3、H2SO4 (3)2Cu+O2+4H+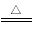 2Cu2++2H2O
2Cu2++2H2O
(4)CuO (5)蒸发浓缩;洗涤
【解析】
试题分析:(1)能和碱反应的只有铝及其氧化物,则滤液的主要成分是偏铝酸钠。
(2)氧化铜、铁以及铁的氧化物均与稀硫酸反应。又因为同时还通入氧化性氧气,因此酸溶后所得溶液中的榕质主要有CuSO4、Fe2(SO4)3、H2SO4。
(3)铜与稀硫酸不反应,但在加热的条件下与氧气反应,反应的离子方程式为2Cu+O2+4H+ 2Cu2++2H2O。
2Cu2++2H2O。
(4)加入试剂的目的是调节溶液的pH,但不能引入新的杂质,所以可以是氧化铜或氢氧化铜或碱式碳酸铜等。
(5)从溶液中获得胆矾的操作应该是蒸发浓缩、冷却结晶、过滤、洗涤、小心干燥即可。
考点:考查胆矾制备的工艺流程图分析与应用


 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源:2014-2015学年上海市长宁区高三上学期教学质量检测化学试卷(解析版) 题型:选择题
现将金属镁和铝的混合物7.5g完全溶解于一定浓度足量的硝酸溶液中,收集反应产生的A 气体。向所得溶液中加入过量烧碱溶液,得到沉淀11.6 g。则气体A的成分可能是
A.0.2mol NO和0.1mol NO2
B.0.3 mol NO
C.0.1mol NO、0.2mol NO2和0.1mol N2O4
D.0.3 mol NO2和0.1mol N2O4
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山西省等四校高三第二次联考化学试卷(解析版) 题型:选择题
在100mL密度为1.2g/mL稀硝酸中,加入一定量的镁和铜组成的混合物,充分反应后金属完全溶解(假设还原产物只有NO),向反应后溶液中加入3mol/L NaOH溶液至沉淀完全,测得生成沉淀质量比原金属质量增加5.1g。则下列叙述不正确是
A.当金属全部溶解时收集到NO气体的体积为2.24L(标准状况)
B.当生成沉淀的量最多时,消耗NaOH溶液体积最小为100mL
C.原稀硝酸的物质的量浓度一定为4 mol/L
D.参加反应金属总质量(m)为9.6g>m>3.6g
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东师大附中高三第四次模拟考试理综化学试卷(解析版) 题型:实验题
(20分)实验室中,用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制备高纯氧化铁( —
—

Fe2O3)的步骤如下:
回答下列问题:
(1)上述实验中,加入铁粉的作用是____________。(用离子方程式表示)实验中检验溶液x中的离子是否与铁粉完全反应的试剂是____________溶液
(2)实验室欲用18.4 mol·L-1。的浓硫酸配制100 mL5.0mol·L-1的硫酸溶液,所用仪器除胶头滴管、量筒、烧杯、玻璃棒外,还有_________(填写仪器名称);
(3)某同学用下图所示装置实现向溶液Y中通入NH3和CO2

①上述装置的中,仪器a的名称是_______;装置B的作用是____________________。
②圆底烧瓶内放置的固体药品为________(填化学式);试管内发生反应的化学方程式为_________________。
③甲、乙、丙三位同学分别用上述装置进行实验,装置C的试剂瓶内溶液体积相等。
若甲、乙两同学实验中,通入的NH3和CO2的物质的量之比分别为2:l和l:l,恰好完全反应后,溶液中水的电离程度 ________(填“>”“=”或“<”)
________(填“>”“=”或“<”) 。
。
若丙同学未用装置D,则反应后溶液中离子浓度间的关系为[H+]+[NH4+]=_______。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东师大附中高三第四次模拟考试理综化学试卷(解析版) 题型:选择题
700℃时,向容枳为2L的密闭容器中充入一定量的CO和H2O发生反应:
CO(g)+H2O(g) 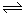 CO2+H2(g)
CO2+H2(g)
反应过程中测定的部分数据见表。下列说法正确的是

A.反应在t1min内的平均速率为v (H2)=0.4/t1 mol·L-1·min-1
B.其他条件不变,起始时向容器中充入0.60molCO和1.20 mo1H2O,到达平衡时,n(CO2)=0.40 mol
C.其他条件不变,向平衡体系中再通入0.2molH2O,达到新平衡时CO转化率减小
D.温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省曲阜市高三上学期期中考试化学试卷(解析版) 题型:选择题
用如图装置进行实验,将液体A逐滴加人到固体B中,下列叙述正确的是

A.若A为浓盐酸,B为KMnO4晶体,C中盛有紫色石蕊溶液,则C中熔液最终呈红色
B.实验仪器D可以起到防止溶液倒吸的作用
C.若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,则C中溶液先产生白色沉淀后沉淀又溶解
D.若A为浓H2SO4.B为Cu,C中盛有澄清石灰水,则C中溶液变浑浊
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省曲阜市高三上学期期中考试化学试卷(解析版) 题型:选择题
Na2O2、HCl、Al2O3三种物质在水中完全反应后,溶液中只含有Na+、H+、Cl-、OH-,且溶液呈中性,则Na2O2、HCl、Al2O3的物质的景之比可能为
A.2:4:1 B.3:2:1 C.2:3:1 D.4:2:1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三1月检测化学试卷(解析版) 题型:选择题
常温下,下列盐溶于水时,能使水的电离程度增大且c(H+)也增大的是
A.NaHSO4 B.KAl(SO4)2 C.NaHCO3 D.CH3COONa
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省常州市高三上学期期末化学试卷(解析版) 题型:填空题
(15分)信息时代产生的大量电子垃圾对环境构成了威胁。某研究性学习小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:

(1)第①步Cu与酸反应的离子方程式为 。
(2)第②步加H2O2的作用是 。
(3)该探究小组提出两种方案测定CuSO4·5H2O晶体的纯度。
方案一:取ag试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.1000 mol·L-1Na2S2O3标准溶液滴定(原理为:I2+2S2O32-===2I-+S4O ),到达滴定终点时,消耗Na2S2O3标准溶液20.00mL。
),到达滴定终点时,消耗Na2S2O3标准溶液20.00mL。
①滴定过程中可选用 作指示剂,滴定终点的现象是 。
②CuSO4溶液与KI反应的离子方程式为 。
方案二:取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol·L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液6 mL。滴定反应如:Cu2++H2Y2-=CuY2-+2H+。
③写出计算CuSO4·5H2O质量分数的表达式ω= 。
④下列操作会导致CuSO4·5H2O含量的测定结果偏高的是 。(填序号)
a.未干燥锥形瓶
b.滴定终点时滴定管尖嘴中产生气泡
c.未除净可与EDTA反应的干扰离子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com