
【题目】(1)常温下,将1 mL pH=1的H2SO4溶液加水稀释到100 mL,稀释后的溶液中![]() =________。
=________。
(2)某温度时,测得0.01 mol·L-1的NaOH溶液的pH为11,则该温度下水的离子积常数Kw=________。该温度________(填“高于”或“低于”)25 ℃。
(3)常温下,设pH=5的H2SO4溶液中由水电离出的H+浓度为c1;pH=5的Al2(SO4)3溶液中由水电离出的H+浓度为c2,则![]() =________。
=________。
(4)常温下,pH=13的Ba(OH)2溶液a L与pH=3的H2SO4溶液b L混合(混合后溶液体积变化忽略不计)。
若所得混合溶液呈中性,则a∶b=________。
若所得混合溶液pH=12,则a∶b=________。
(5)在(2)所述温度下,将pH=a的NaOH溶液VaL与pH=b的硫酸Vb L混合。
①若所得混合液为中性,且a=12,b=2,则Va∶Vb=________。
②若所得混合液的pH=10,且a=12,b=2,则Va∶Vb=________。
【答案】 108 1×10-13 高于 10-4 1∶100 11∶90 1∶10 1∶9
【解析】(1)1mL pH=1的H2SO4溶液加水稀释到100mL,c(H+)由0.1mol/L变为0.001mol/L,则稀释后溶液的pH=-lg0.001=3;(2)常温下,0.01mol/L的NaOH溶液的pH为12,而某温度时测得0.01mol/L的NaOH溶液的pH为11,则KW=0.01×10-11=1.0×10-13,温度高于25℃;
(3)硫酸溶液中的氢氧根离子、硫酸铝溶液中的氢离子是水电离的,pH=5的硫酸溶液中由水电离出的H+浓度为c1=![]() =10-9mol/L,pH=5的Al2(SO4)3溶液中由水电离出的H+浓度为c2=10-5mol/L,则c1:c2=10-9mol/L:10-5mol/L=1:10000;(4)若所得混合溶液呈中性,则硫酸中的氢离子与氢氧化钡的氢氧根离子的物质的量相等,即:aL×0.1mol/L=bL×0.001mol/L,解得a:b=1:100;若所得混合溶液pH=12,溶液显示碱性,碱过量,则:
=10-9mol/L,pH=5的Al2(SO4)3溶液中由水电离出的H+浓度为c2=10-5mol/L,则c1:c2=10-9mol/L:10-5mol/L=1:10000;(4)若所得混合溶液呈中性,则硫酸中的氢离子与氢氧化钡的氢氧根离子的物质的量相等,即:aL×0.1mol/L=bL×0.001mol/L,解得a:b=1:100;若所得混合溶液pH=12,溶液显示碱性,碱过量,则:
![]() =0.01mol/L,解得a:b=11:90;(5)①若所得混合溶液为中性,且a=12,b=2,因c(OH-)×Va=c(H+)×Vb,a=11,溶液中氢氧根离子浓度为0.1mol/L,b=2,则氢离子浓度为0.01mol/L,则0.1×Va=0.01Vb,则Va:Vb=1:10;②若所得混合溶液的pH=10,混合液中碱过量,该温度下氢氧根离子浓度为0.001mo/L,a=12,氢氧根离子浓度为0.1mol/L,b=2,溶液中氢离子浓度为0.01mol/L,则c(OH-)=
=0.01mol/L,解得a:b=11:90;(5)①若所得混合溶液为中性,且a=12,b=2,因c(OH-)×Va=c(H+)×Vb,a=11,溶液中氢氧根离子浓度为0.1mol/L,b=2,则氢离子浓度为0.01mol/L,则0.1×Va=0.01Vb,则Va:Vb=1:10;②若所得混合溶液的pH=10,混合液中碱过量,该温度下氢氧根离子浓度为0.001mo/L,a=12,氢氧根离子浓度为0.1mol/L,b=2,溶液中氢离子浓度为0.01mol/L,则c(OH-)=![]() =0.001mol/L,解得:Va:Vb=1:9。
=0.001mol/L,解得:Va:Vb=1:9。


科目:高中化学 来源: 题型:
【题目】空气是一种宝贵的自然资源,下列有关说法正确的是( )
A.稀有气体约占空气质量的0.03%
B.空气质量指数级别越大,空气质量越好
C.氮气常温下化学性质稳定,可用于生产氮肥
D.氦气可用于填充探空气球
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法中不正确的是( )
A. 一定条件下,将1g乙炔溶于12g苯,所得混合物中含有的碳原子数为NA
B. l04g苯乙烯中含有8NA个碳氢键和NA个碳碳双键
C. 在100g质量分数为46%的乙醇水溶液中,含有氢原子数为12NA
D. 14g分子式为CnH2n的烃中含有的碳碳双键数为NA/n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知次磷酸(H3PO2)为一元酸,欲证明它是弱电解质,下列操作方法不正确的是
A. 用物质的量浓度相同的NaCl溶液和NaH2PO2溶液进行导电性实验,比较灯泡的亮度
B. 用一定浓度的NaOH溶液分别滴定等体积、等pH的盐酸和次磷酸溶液,比较消耗碱液的体积
C. 加热滴有酚酞试液的NaH2PO2溶液,溶液颜色变深
D. 常温下,稀释0.1mol·L-1次磷酸溶液至原溶液体积的100倍,测得pH在4~5之间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应3A(g)+2B(g) ![]() 4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是( )
4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是( )
A. 该反应的化学平衡常数表达式是![]()
B. 此时,B的平衡转化率是40%
C. 增大该体系的压强,化学平衡常数增大
D. 增加B,B的平衡转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2 通入 BaCl2 溶液中并不产生沉淀,而通入另一种气体后可以产生白色沉淀。则图中右侧 Y 形管中放置的药品组合符合要求的是( )
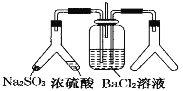
①Cu 和浓硝酸 ②氢氧化钠固体和浓氨水 ③大理石和稀盐酸 ④过氧化氢和二氧化锰
A. ①②④B. 全部C. ②③D. ①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积为2L的密闭容器中发生反应CO(g)+H2O(g) ![]() CO2(g)+H2(g),部分数据见下表(表中t2>t1)
CO2(g)+H2(g),部分数据见下表(表中t2>t1)
反应时间/min | n(CO)/mol | n(H2O)/mol | n(CO2)/mol | n(H2)/mol |
0 | 1.20 | 0.60 | 0 | 0 |
t1 | 0.80 | |||
t2 | 0.20 |
下列说法正确的是
A. 反应在t1min末的速率为v(H2)=0.40/t1 mol·L-1·min-1
B. 平衡时CO的转化率为66.67%
C. 该温度下反应的平衡常数为1
D. 其他条件不变,若起始时,n(CO)=0.60 mol,n(H2O)=1.20 mol,则平衡时n(CO2)=0.20mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如图所示。 下列说法正确的是

A. 283K时,图中a点对应的溶液是不饱和溶液
B. 温度一定时,Ksp(SrSO4) 随c(SO42-) 的增大而减小
C. 283K下的SrSO4饱和溶液升温到363K后变为不饱和溶液
D. 三个不同温度中,363K时Ksp(SrSO4)最大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com