
| 0.25mol×16mol |
| 2mol |
| 0.25mol×5mol |
| 2mol |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
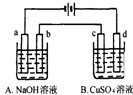 按如图装置进行电解(均是惰性电极),已知A烧杯中装有500mL20%的NaOH溶液,B烧杯中装有500mL pH为6的1mol?L-1CuSO4溶液.通电一段时间后,在b电极上收集到28mL气体(标准状况),则B烧杯中溶液pH变为(溶液体积变化忽略不计)( )
按如图装置进行电解(均是惰性电极),已知A烧杯中装有500mL20%的NaOH溶液,B烧杯中装有500mL pH为6的1mol?L-1CuSO4溶液.通电一段时间后,在b电极上收集到28mL气体(标准状况),则B烧杯中溶液pH变为(溶液体积变化忽略不计)( )| A、4 | B、3 | C、2 | D、1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 | 400 | 500 | 800 |
| 平衡常数 | 9.94 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 反应时间/min | n(SiF4)/mol | n(H2O)/mol |
| 0 | 1.2 | 2.4 |
| t1 | 0.8 | |
| t2 | 1.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com