

| A. | Fe | B. | C | C. | Cl2 | D. | N2 |
分析 A.Fe和氢气不反应,铁的氧化物不溶于水;
B.碳和氢气不反应,碳和氧气反应生成CO,CO和氧气反应生成CO2,CO2溶于水生成碳酸,碳酸和铜不反应;
C.Cl2和氧气不反应,氯化氢和氧气不反应;
D.N2和H2反应生成氨气,氨气催化氧化生成NO,N2和氧气反应生成NO,NO和氧气反应生成NO2,NO2和水反应生成HNO3和NO,HNO3和铜反应生成NO.
解答 解:A.Fe和氢气不反应,铁的氧化物不溶于水,故A错误;
B.碳和氢气不反应,碳和氧气反应生成CO,CO和氧气反应生成CO2,CO2溶于水生成碳酸,碳酸和铜不反应,不能实现上述转化,故B错误;
C.Cl2和氧气不反应,氯气和氢气反应生成氯化氢气体,氯化氢和氧气不反应,故C错误;
D.N2和H2反应生成氨气,N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3,氨气催化氧化生成NO,4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,N2和氧气反应生成NO,N2+O2=2NO,NO和氧气反应生成NO2,2NO+O2=2NO2,NO2和水反应生成HNO3和NO,3NO2+H2O=2HNO3+NO,HNO3和铜反应生成NO,3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,故D正确;
故选D.
点评 本题考查了元素化合物性质的熟练掌握,主要是铁、碳、氯、氮气及其化合物性质的应用,题目难度中等.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
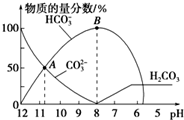
| A. | 在A点所示的溶液中:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-) | |
| B. | 在B点所示的溶液中,浓度最大的离子是Na+ | |
| C. | 当溶液的pH为7时,溶液的总体积大于20mL | |
| D. | 25℃时,CO32-水解常数Kh=2×10-4mol•L-1,当溶液中c(HCO3-):c(CO32-)=2:1时,溶液的pH=10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 苯丙酸诺龙分子中没有手性碳原子 | |
| B. | 苯丙酸诺龙属于芳香烃 | |
| C. | 苯丙酸诺龙既能使溴的四氯化碳溶液又能使酸性KMnO4溶液褪色 | |
| D. | 1mol苯丙酸诺龙最多可与2 mol的NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3H6 | B. | C2H4 | C. | C4H6 | D. | C2H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol H2O含有的原子数目为1.5NA | |
| B. | 32g O2所含的原子数目为NA | |
| C. | 1mol H2O含有的H2O分子数目为NA | |
| D. | 0.5NA个氯气分子的物质的量是0.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有共价键的化合物一定为共价化合物 | |
| B. | 含有离子键的化合物一定为离子化合物 | |
| C. | 吸热反应中,旧化学键断裂吸收能量;放热反应中,旧化学键断裂放出能量 | |
| D. | 吸热反应中,新化学键形成吸收能量;放热反应中,新化学键形成放出能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烯和环丙烷组成的42 g混合气体中氢原子的个数为6NA | |
| B. | 标准状况下,4.48 L己烷含有的分子数为0.2NA | |
| C. | 标准状况下,6.72LNO2与水反应消耗的氧化剂分子数为0.2NA | |
| D. | 1 mol OD-离子含有的质子、中子数均为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
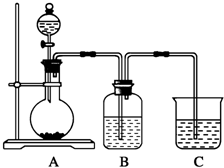 某同学设计实验以探究元素性质的递变规律,实验装置如图所示.
某同学设计实验以探究元素性质的递变规律,实验装置如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com