
| 时间(s) | 0 | 500 | 1000 | 1500 |
| c(N2O5)(mol•L) | 0.50 | 0.35 | 0.25 | 0.25 |
分析 (1)前500s c(N2O5)=0.35mol•L,浓度变化=0.5mol/L-0.35mol/L=0.15mol/L,表示的反应速率v(N2O5)=$\frac{△c}{△t}$,反应速率之比等于化学方程式计量数之比计算NO2的反应速率;
(2)在一定温度下,该反应1000s时达到平衡,c(N2O5)=0.25mol•L,结合化学平衡三行计算列式计算平衡浓度,平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;
(3)计算此时浓度商Qc和平衡常数K比较大小判断反应进行方向.
解答 解:(1)前500s c(N2O5)=0.35mol•L,浓度变化=0.5mol/L-0.35mol/L=0.15mol/L,表示的反应速率v(N2O5)=$\frac{△c}{△t}$=$\frac{0.15mol/L}{500s}$=0.0003mol/(L•s),反应速率之比等于化学方程式计量数之比计算NO2的反应速率,v(NO2)=2v(N2O5)=0.0006mol/(L•s),
故答案为:0.0006mol/(L•s);
(2)在一定温度下,该反应1000s时达到平衡,c(N2O5)=0.25mol•L,结合化学平衡三行计算列式计算平衡浓度,
2N2O5(g)?4NO2(g)+O2(g)
起始量(mol/L) 0.5 0 0
变化量(mol/L) 0.25 0.5 0.125
平衡量(mol/L) 0.25 0.5 0.125
平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$=$\frac{0.125×0.{5}^{4}}{0.2{5}^{2}}$=0.125,
答:该温度下平衡常数为0.125;
(3)计算此时浓度商Qc=$\frac{0.{5}^{4}×(0.125+0.375)}{(0.25+0.25)^{2}}$=0.125=K,说明平衡不动,此时N2O5的体积分数可以利用原平衡状态计算=$\frac{0.25}{0.25+0.5+0.125}$×100%=28.57%,
答;平衡不动,此时N2O5的体积分数28.57%.
点评 本题考查了化学反应速率、化学平衡常数计算、平衡影响因素的分析应用、化学反应进行方向的判断等知识点,注意知识的熟练掌握,题目难度不大.


科目:高中化学 来源: 题型:选择题
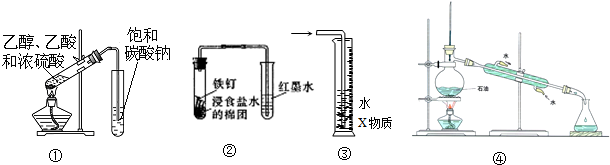
| A. | 装置①可用于实验室制取乙酸乙酯 | |
| B. | 装置②可观察铁的吸氧腐蚀 | |
| C. | 装置③中X为四氯化碳,该装置可用于吸收氨气或氯化氢 | |
| D. | 装置④为实验室蒸馏石油装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光照下能够发生取代反应 | B. | 分子中碳原子一定在同一平面上 | ||
| C. | 比丁烷更易液化 | D. | 是石油分馏的一种产品 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同温度时,100mL0.01mol/L的醋酸溶液与10mL0.1mol/L的醋酸溶液相比较,H+的物质的量前者等于后者 | |
| B. | 在稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3KJ/mol,若将含1mol CH3COOH的稀溶液与含1molNaOH的稀溶液混合,放出的热量小于57.3KJ | |
| C. | 反应2Mg(s)+CO2(g)═C(s)+2MgO(s)能自发进行,则该反应的△H>0 | |
| D. | N2(g)+3H2(g)═2NH3(g)△H<0.其他条件不变时升高温度,反应速率和氢气的平衡转化率均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 对苯二酚在空气中能稳定存在 | |
| B. | 1 mol该中间体最多可与11 mol H2反应 | |
| C. | 2,5-二羟基苯乙酮能发生加成、取代、缩聚反应 | |
| D. | 该中间体分子最多可以消耗4 molNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
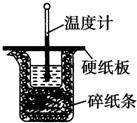 50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com