
下面对数据资料的利用不正确的是
| A.利用热效应大小可以判断某些物质的稳定性强弱 |
| B.利用密度数据可判断液体混合物是否可以通过蒸馏分离 |
| C.利用原子(或离子)半径数据可推断某些原子(或离子)的氧化性和还原性的强弱 |
| D.利用溶解度数据可推测将一些物质混合物分离开来的可能性 |
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案科目:高中化学 来源: 题型:单选题
已知:N2(g)+3H2(g) ? 2 NH3(g) △H =" -92.4" kJ/mol。一定条件下,现有容积相同且恒容的密闭容器甲与乙:① 向甲中通入1 mol N2和3 mol H2,达到平衡时放出热量Q1 kJ;② 向乙中通入0.5 mol N2 和1.5 mol H2,达到平衡时放出热量Q2 kJ。则下列关系式正确的是
| A.92.4>Ql>2Q2 | B.92.4=Q1<2Q2 |
| C.Q1=2Q2=92.4 | D.Q1=2Q2<92.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1
H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1
下列说法正确的是( )
| A.H2(g)的燃烧热为 -571.6 kJ·mol-1 |
| B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多 |
C.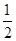 H2SO4(aq)+ H2SO4(aq)+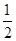 Ba(OH)2(aq)= Ba(OH)2(aq)= 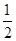 BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1 BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1 |
| D.3H2(g)+CO2(g)= CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在生产和生活中,人们广泛利用着化学反应释放的能量。下列说法正确的是( )
| A.物质发生化学变化并不一定都伴随着能量变化 |
| B.用实验方法和理论方法研究反应热的化学称为热化学 |
| C.有能量变化的都是化学变化 |
| D.任何反应中的能量变化都表现为热量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
测定稀盐酸和氢氧化钠稀溶液中和热的实验中没有使用的仪器有:①大、小烧杯;②容量瓶;③量筒;④环形玻璃搅拌棒;⑤试管;⑥温度计;⑦蒸发皿;⑧托盘天平中的( )
| A.①②⑥⑦ | B.②⑤⑦⑧ | C.②③⑦⑧ | D.③④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知盐酸与硫酸跟烧碱的稀溶液反应的热化学方程式为:H+(aq)+OH-(aq) H2O(l) ΔH=Q1 kJ·mol-1,又知:H2SO4(aq)+2KOH(aq)
H2O(l) ΔH=Q1 kJ·mol-1,又知:H2SO4(aq)+2KOH(aq) K2SO4(aq)+2H2O(l)ΔH=Q2 kJ·mol-1。则Q1和Q2的关系是( )
K2SO4(aq)+2H2O(l)ΔH=Q2 kJ·mol-1。则Q1和Q2的关系是( )
| A.Q1=Q2 | B.2Q1=Q2 | C.Q1<Q2 | D.无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知反应A+B=C+D为放热反应,对该反应的下列说法正确的是( )。
| A.A的能量一定高于C |
| B.B的能量一定高于D |
| C.A和B的总能量一定高于C和D的总能量 |
| D.该反应为放热反应,故不必加热就一定能发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
参照反应Br+H2 HBr+H的能量对反应历程的示意图。下列叙述正确的是( )
HBr+H的能量对反应历程的示意图。下列叙述正确的是( )
| A.正反应为放热反应 |
| B.加入催化剂,该化学反应的反应热变大 |
| C.反应物总能量低于生成物总能量 |
| D.升高温度可增大正反应速率,降低逆反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在25℃、101 kPa条件下,C(s)、H2(g)、CH3COOH(l)的燃烧热分别为393.5kJ/mol、285.8kJ/mol、870.3kJ/mol,则2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应热为 ( )
| A.-488.3 kJ/mol | B.+488.3 kJ/mol |
| C.-191 kJ/mol | D.+191 kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com