
| A. | 赤铁矿的主要成分是Fe3O4 | |
| B. | 铁与水蒸气在高温下的反应产物为Fe2O3和H2 | |
| C. | Fe(OH)2不稳定,在潮湿的空气中很容易被氧化 | |
| D. | 含Fe2+的溶液滴加KSCN后溶液变红色 |
分析 A.赤铁矿的主要成分是Fe2O3;
B.铁与水蒸气反应生成四氧化三铁和氢气;
C.氢氧化亚铁具有还原性,能够被空气中氧气氧化生成氢氧化铁;
D.三价铁离子与到KSCN后溶液变红色.
解答 解:A.赤铁矿的主要成分是Fe2O3,故A错误;
B.铁与水蒸气反应生成四氧化三铁和氢气,方程式:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,故B错误;
C.氢氧化亚铁具有还原性,能够被空气中氧气氧化生成氢氧化铁,方程式:4Fe(OH)2+2H2O+O2═4Fe(OH)3,故C正确;
D.三价铁离子与到KSCN后溶液变红色,含Fe2+的溶液滴加KSCN后溶液不变色,故D错误;
故选:C.
点评 本题考查了元素化合物知识,熟悉铁及其化合物性质是解题关键,注意二价铁离子、三价铁离子性质区别及检验方法,题目难度不大.


科目:高中化学 来源: 题型:解答题
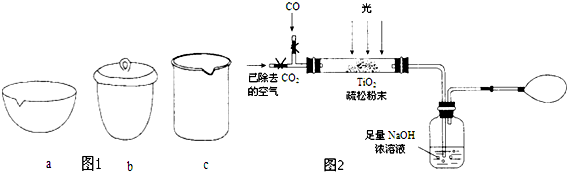
| 资料卡片 | ||
| 物质 | 熔点 | 沸点 |
| SiCl4 | -70℃ | 57.6℃ |
| TiCl4 | -25℃ | 136.5℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
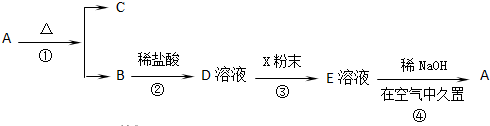
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠浮在水面上,四处游动 | |
| B. | 反应放出的热量使得钠熔化成一个小球 | |
| C. | 反应完后烧杯中有蓝色不溶物 | |
| D. | 反应完后烧杯中出现红色不溶物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温时,在水中的溶解性:碳酸钠>碳酸氢钠 | |
| B. | 热稳定性:碳酸钠<碳酸氢钠 | |
| C. | 质量相同时,分别与同体积同浓度盐酸反应的快慢:碳酸钠>碳酸氢钠 | |
| D. | 物质的量相同时,分别与足量的盐酸反应,生成CO2的质量:碳酸钠<碳酸氢钠 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com