
【题目】
I.某化学兴趣小组对下列三组物质进行研究:
A.HCl、H2SO4、H2CO3、HNO3
B.溶液、水、悬浊液、胶体
C.Na2CO3、NaNO3、AgNO3、Ba(NO3)2
请你帮他们完善下列空白:
A | B | C | |
分类标准 | 含氧酸 | 分散系 | (3) |
不属于该类别的物质 | (1) | (2) | Na2CO3 |
II.“探险队员”——盐酸,不小心走进了化学迷宫,不知怎样走出来,因为迷宫有许多“吃人的野兽”(即能与盐酸反应的物质),盐酸必须避开它们,否则就无法通过。
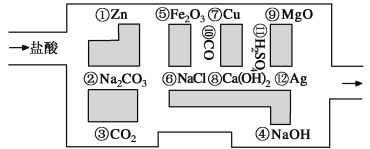
(1)请你帮助它走出迷宫(请用图中物质前的序号连接起来表示所走的路线):________________。
(2)在能“吃掉”盐酸的化学反应中,属于酸和碱中和反应的有________个,其中能“吃掉”盐酸的盐是____________,写出该反应的离子方程式 。
【答案】I.(1)HCl(1分); (2)水(1分); (3)硝酸盐(1分)
II.(1)③⑥⑩⑦(2分)
(2)2(2分) Na2CO3 (1分) CO32-+2H+===H2O+CO2↑(2分);
【解析】
试题分析:Ⅰ.某化学兴趣小组对下列三组物质进行研究:
A.HCl、H2SO4、H2CO3、HNO3不属于含氧酸为:HCl。
B.溶液、水、悬浊液、胶体中不属于分散系(为混合物)为:HCl。
C.Na2CO3为钠盐和碳酸盐,所以分类标准为:硝酸盐。
II.(1)利用图示的物质对相关的与盐酸不能反应的物质作出判断即可,由于盐酸不能和二氧化碳、二氧化硫、硫酸、氯气反应。
(2)中和反应是酸与碱反应,根据碱的种类确定中和反应的个数,碱有2种,则中和反应有2个;其中能“吃掉” 盐酸的是Na2CO3;该反应的离子方程式为:CO32-+2H+=H2O+CO2↑。


科目:高中化学 来源: 题型:
【题目】

⑴如图所示的仪器中配制溶液肯定不需要的是 (填序号),仪器C的名称是 ,本实验所需玻璃仪器E规格为 mL。
⑵下列操作中,容量瓶所不具备的功能有 (填序号)。
A.配制一定体积准确浓度的标准溶液 | B.长期贮存溶液 |
C.用来加热溶解固体溶质 | D.量取一定体积的液体 |
⑶在配制NaOH溶液实验中,其他操作均正确。若定容时仰视刻度线, 则所配制溶液浓度 0.1 mol/L(填“大于”“等于”或“小于”,下同);若NaOH溶液未冷却即转移至容量瓶定容,则所配制溶液浓度 0.1 mol/L。
⑷由计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸体积为 mL(计算结果保留一位小数)。如果实验室有10 mL、25mL、50 mL量筒,应选用 mL规格的量筒最好。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.硫酸镁溶液跟氢氧化钡溶液反应:![]() +Ba2+=BaSO4↓
+Ba2+=BaSO4↓
B.硫酸和氢氧化铜溶液混合:H++OH=H2O
C.澄清石灰水中加入盐酸Ca(OH)2+2H+=Ca2++2H2O
D.铜片插入硝酸银溶液中:Cu+2Ag+=Cu2++2Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某K2SO4和Fe2(SO4)3的混合溶液中, Fe3+物质的量浓度为0.1摩/升,SO42-物质的量浓度为0.3摩/升,则K+的物质的量浓度为( )摩/升。
A.0.6 B.0.3 C.0.2 D.0.15
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关水在人体中的作用,下列说法正确的是( )
A. 水是一种很好的溶剂
B. 水在人体内没有调节体温的作用
C. 饮用水越纯净越好
D. 没有污染的水就是纯净水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应①:CO(g)+CuO(s)![]() CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)
CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)![]() Cu(s)+H2O(g)在相同的温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g)
Cu(s)+H2O(g)在相同的温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数为K.则下列说法正确的是
CO2(g)+H2(g)的平衡常数为K.则下列说法正确的是
A.反应①的平衡常数K1=[c(CO2)c(Cu)]/[c(CO)c(CuO)]
B.对于反应③,恒容时,温度升高,H2的浓度减小,则该反应的焓变为正值
C.反应③的平衡常数K=K1/K2
D.对于反应③,恒温恒容下,增大压强,H2的浓度一定减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com