

| A. | 正极反应为:Zn-2e-═Zn2+ | |
| B. | 电池反应为:Zn+Cu2+═Zn2++Cu | |
| C. | 在外电路中,电子从铜电极流向锌电极 | |
| D. | 盐桥中的K+移向ZnSO4溶液 |
分析 铜锌原电池中,锌较活泼,为原电池的负极,发生Zn-2e-=Zn2+,铜为正极,发生Cu2++2e-=Cu,原电池工作时,电子从电池负极经外电路流向正极,溶液中阳离子向正极移动,以此解答该题
解答 解:A.正极上铜离子得电子生成Cu,正极反应为Cu2++2e-=Cu,故A错误;
B.电池总反应为锌置换出铜,为Zn+Cu2+=Zn2++Cu,故B正确;
C.电子从电池负极经外电路流向正极,即电子从锌电极流向铜电极,故C错误;
D.溶液中阳离子向正极移动,则盐桥中的K+移向CuSO4溶液,故D错误;
故选B.
点评 本题考查原电池的工作原理,注意把握原电池的工作原理以及电极方程式的书写,题目难度不大,注意电子流向和离子流向的判断.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
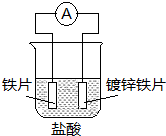
| A. | 溶液中pH值明显下降 | B. | 阴极的电极反应式:Fe-2e→Fe2+ | ||
| C. | 铁片为正极,镀锌铁片为负极 | D. | 电子由锌经溶液流向铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
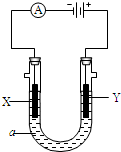 电解原理在化学工业中有广泛应用,如图为工业制氯气的装置原理.U型管中装有电解液a;X、Y是两根电极棒,通过导线与直流电源相连,实验开始时,同时在两边各滴入几滴酚酞试液.请回答以下问题:
电解原理在化学工业中有广泛应用,如图为工业制氯气的装置原理.U型管中装有电解液a;X、Y是两根电极棒,通过导线与直流电源相连,实验开始时,同时在两边各滴入几滴酚酞试液.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯碱工业是电解熔融的NaCl,阳极产生Cl2 | |
| B. | 氢氧燃料电池可将热能直接转化为电能 | |
| C. | 原电池工作时,电子从负极经外电路移向正极 | |
| D. | 工业上电解熔融的AlCl3来制取铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
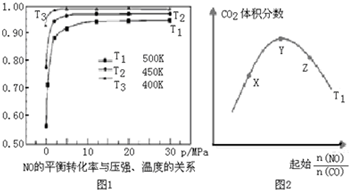
 人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注.CO2和H2在一定条件下反应生成甲醇(CH3OH)等产生,工业上利用该反应合成甲醇.
人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注.CO2和H2在一定条件下反应生成甲醇(CH3OH)等产生,工业上利用该反应合成甲醇.| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
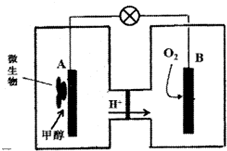
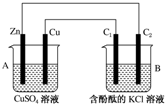 按如图所示装置进行实验,并回答下列问题:
按如图所示装置进行实验,并回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
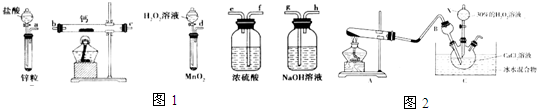
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com