
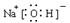 .
.分析 A、B、C、D、E、F六种短周期元素的原子序数依次增大,A能分别与B、C形成电子总数都为10的分子,且A与C能形成两种常温下为液态的化合物,两种液态化合物为H2O、H2O2,可知A为H元素、C为O元素,A、B的最外层电子数之和与C的最外层电子数相等,则B为N元素,A与D同主族、C与E同主族,D、E、F同周期,则D为Na、E为S、F为Cl,据此解答.
解答 解:A、B、C、D、E、F六种短周期元素的原子序数依次增大,A能分别与B、C形成电子总数都为10的分子,且A与C能形成两种常温下为液态的化合物,两种液态化合物为H2O、H2O2,可知A为H元素、C为O元素,A、B的最外层电子数之和与C的最外层电子数相等,则B为N元素,A与D同主族、C与E同主族,D、E、F同周期,则D为Na、E为S、F为Cl.
(1)C为元素,在周期表中的位置为:第二周期VIA族,故答案为:第二周期VIA族;
(2)电子层结构相同的离子,核电荷数越大离子半径越小,离子的电子层越多离子半径越大,故离子半径:S2->Cl->Na+,故答案为:S2-;
(3)A、C、D三种元素组成的一种常见化合物,是重要的工业产品,该化合物为NaOH,电子式为 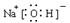 ,故答案为:
,故答案为: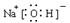 ;
;
(4)非金属性Cl>S,则气态氢化物的稳定为HCl>H2S,故答案为:HCl;
(5)N与Cl两种元素形成的一种化合物中各原子均满足8电子的稳定结构,该化合物为NCl3,两种元素还能形成另一种化合物,其中N元素显最高正价,该化合物为NCl5,该化合物能与水反应生成两种酸,该化合物与水反应的化学方程式:NC15+3H2O=HNO3+5HCl,
故答案为:NCl3;NC15+3H2O=HNO3+5HCl.
(6)A为H元素,B为N元素,C为O元素,三种元素形成的一种常见化合物,其浓溶液在常温下可与铜反应,该化合物为HNO3,该反应的离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO2↑+4H2O,
故答案为:3Cu+8H++2NO3-=3Cu2++2NO2↑+4H2O.
点评 本题考查位置结构性质的关系及应用,综合性较强,考查知识点较多,推断元素是解答本题的关键,A与C形成的化合物常温下为液态是推断突破口,熟悉元素化合物的性质.


 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 纤维素和淀粉的组成都可用(C6H10O5)n表示,它们互为同分异构体 | |
| B. | 油脂的酸性条件下的水解叫皂化反应 | |
| C. | 将AlCl3溶液和Al2(SO4)3溶液分别蒸干灼烧,所得产物的成分均为Al2O3 | |
| D. | 由反应AgCl (s)+KI(aq)?AgI(s)+KCl(aq)可知Ksp(AgCl)>Ksp(AgI) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
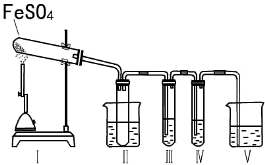
| 操作步骤 | 预期实验现象 | 预期实验结论 |
| 向其中一份溶液中加入KSCN溶液(或硫氰化钾溶液) | 溶液变成血红色 | 固体中含有Fe2O3 |
| 向另一份溶液中滴加2滴黄色K3[Fe(CN)6]溶液 | 产生蓝色沉淀 | 固体中含有FeO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
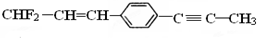
| A. | 所有原子共面 | |
| B. | 12个碳原子不可能共平面 | |
| C. | 除苯环外的其余碳原子不可能共直线 | |
| D. | 除苯环外的其余碳原子可能共直线 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖可以水解成乙醇 | B. | 石油裂解气产物可用于制备塑料 | ||
| C. | CH2═CH2和CH3CH2Cl 都属于烃 | D. | 蛋白质、油脂均属高分子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com