
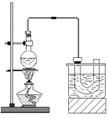
 实验室制备溴乙烷(C2H5Br)的装置和步骤如下:(已知溴乙烷的沸点38.4℃)①检查装置的气密性,向装置图所示的∪形管和大烧杯中加入冰水;②在圆底烧瓶中加入10mL95%乙醇、28mL78%浓硫酸,然后加入研细的13g溴化钠和几粒碎瓷片;③小心加热,使其充分反应.回答下列问题:
实验室制备溴乙烷(C2H5Br)的装置和步骤如下:(已知溴乙烷的沸点38.4℃)①检查装置的气密性,向装置图所示的∪形管和大烧杯中加入冰水;②在圆底烧瓶中加入10mL95%乙醇、28mL78%浓硫酸,然后加入研细的13g溴化钠和几粒碎瓷片;③小心加热,使其充分反应.回答下列问题:分析 (1)乙醇、浓硫酸和溴化钠加热反应生成溴乙烷、硫酸氢钠和水;
(2)浓硫酸具有强氧化性,温度过高会把溴离子氧化成红棕色的溴,同时浓硫酸被还原成二氧化硫;
(3)为了更好的控制温度,最好用水浴加热的方法;
(4)U型管得到了溴乙烷;
(5)溴乙烷中混有溴,除杂时注意溴和溴乙烷的性质角度考虑;分液用到分液漏斗;将溴乙烷与水分离采用蒸馏操作;
(6)检验溴乙烷中溴元素,应在碱性条件下水解,最后加入硝酸酸化,加入硝酸银,观察是否有黄色沉淀生成;有溴乙烷参加的主要反应是溴乙烷和碱溶液中的水解.
解答 解:(1)溴化钠、浓硫酸和乙醇制取溴乙烷的化学方程式为:NaBr+H2SO4+C2H5OH$\stackrel{△}{→}$NaHSO4+C2H5Br+H2O,
故答案为:NaBr+H2SO4+C2H5OH$\stackrel{△}{→}$NaHSO4+C2H5Br+H2O;
(2)由于浓硫酸具有强氧化性,会有溴生成,化学式为Br2,同时浓硫酸被还原成SO2,因此无色气体为SO2和H2O,
故答案为:Br2;SO2和H2O;
(3)为了更好的控制温度,最好用水浴加热的方法,
故答案为:水浴加热;
(4)U型管得到了溴乙烷,因此可观察到有油状液体生成,
故答案为:有油状液体生成;
(5)粗制的C2H5Br呈棕黄色,说明含有单质溴杂质,则,
a.溴乙烷能够与氢氧化钠反应,故A错误;
b.溴在溴乙烷中的溶解度比在水中大,加水难以除去溴乙烷中的溴,故B错误;
c.Na2SO3与溴发生氧化还原反应,Na2SO3可除去溴,故C正确;
d.溴和溴乙烷都能溶于四氯化碳,不能将二者分离,故D错误;
分液使用的主要仪器是分液漏斗,要进一步制得纯净的C2H5Br,可用水洗,然后加入无水CaCl2,利用沸点不同再进行蒸馏分离,
故答案为:c;分液漏斗;蒸馏;
(6)检验溴乙烷中溴元素,应在碱性条件下水解,最后加入硝酸酸化,加入硝酸银,观察是否有黄色沉淀生成,所以操作顺序为④①⑤③②,
故答案为:④①⑤③②.
点评 本题主要考查了溴乙烷的制备,掌握相关物质的基本化学性质是解答本题的关键,平时须注意积累相关反应知识,本题难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 难溶于水的BaCO3是弱电解质 | |
| B. | 0.1mol/L的CH3COOH溶液中H+浓度为0.1mol/L | |
| C. | 强电解质水溶液的导电能力一定比弱电解质的强 | |
| D. | 电解质溶液导电的原因是溶液中有自由移动的阴、阳离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2能与酸反应生成盐和水,所以过氧化钠是碱性氧化物 | |
| B. | Na2O2中阴、阳离子的个数比为1:1 | |
| C. | Na2O2与CO2反应,每消耗1mol Na2O2,转移电子的物质的量为1mol | |
| D. | Na2O2的漂白原理与活性炭的漂白原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应中,反应物总能量与生成物总能量 | |
| B. | 化学反应中,反应物总质量与生成物总质量 | |
| C. | 溶液中,稀释前溶质质量与稀释后溶质质量 | |
| D. | 在化合物中,正化合价总数与负化合价总数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸溶液中存在H+、CH3COOH、CH3COO-等微粒,故醋酸是弱电解质 | |
| B. | “水滴石穿”主要是溶解了CO2的雨水与CaCO3长期作用生成可溶性的Ca(HCO3)2的缘故 | |
| C. | 硫酸、纯碱、小苏打和二氧化硫分别属于酸、碱、盐和酸性氧化物 | |
| D. | 浓硝酸在光照下颜色变黄,说明浓硝酸不稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com