
近年来,加“碘”食盐较多的使用了碘酸钾(KIO3),碘酸钾在工业上可用电解法制取。以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应方程式为:KI + 3H2O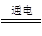 KIO3 + 3H2↑。下列有关说法正确的是
KIO3 + 3H2↑。下列有关说法正确的是
| A.电解时,石墨作阴极,不锈钢作阳极 |
| B.电解时,阳极反应是:I –-6e–+ 3H2O = IO3 – + 6H+ |
| C.在KI溶液溶液中加入酚酞,电解时阳极区变红色 |
| D.电解时溶液中I –向阴极迁移 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:单选题
如图装置,U形管中装有50 mL 2 mol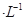 的CuSO4溶液。通电一段时间后,下列说法正确的是
的CuSO4溶液。通电一段时间后,下列说法正确的是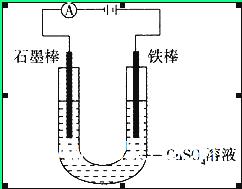
| A.转移0.2 mol电子时,阳极减少质量大于阴极增加质量 |
| B.转移0.4 mol电子时,阴极得到2.24 L标准状况下的气体 |
| C.电解一段时间后,U形管中会产生红褐色物质,后来逐渐溶解 |
| D.若将石墨棒换成铜棒,可实现铁制品上镀铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
通以相等的电量,分别电解等浓度的硝酸银和硝酸亚汞(亚汞的化合价为+1)溶液,若被还原的硝酸银和硝酸亚汞的物质的量之比n(硝酸银)︰n(硝酸亚汞)=2︰1,则下列表述正确的是 ( )
| A.在两个阴极上得到的银和汞的物质的量之比n(银)︰n(汞)=2︰1 |
| B.在两个阳极上得到的产物的物质的量不相等 |
| C.硝酸亚汞的化学式为HgNO3 |
| D.硝酸亚汞的化学式为Hg2(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
用如图所示的装置进行实验,反应一段时间后断开K,向右侧烧杯中加入0.1 mol CuO后CuSO4溶液恰好恢复到反应前的浓度和pH。下列说法中不正确的是 ( )
| A.铜棒为正极,其电极反应式为:2H++2e-====H2↑ |
| B.烧杯右侧碳棒为阴极,其电极表面有红色物质析出 |
| C.反应中消耗锌的质量为13 g |
| D.导线中通过电子的物质的量为0.2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
镍氢电池的总反应为 H2+2NiO(OH) 2Ni(OH)2,根据此反应式判断,此电池放电时,正极上发生反应的物质是( )。
2Ni(OH)2,根据此反应式判断,此电池放电时,正极上发生反应的物质是( )。
| A.NiO(OH) | B.Ni(OH)2 |
| C.H2 | D.H2和NiO(OH) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在标准状况下,用铂电极电解CuSO4溶液,当阴极产生12.8g铜时,阳极放出的气体是( )
| A.1.12LH2 | B.1.12LO2 | C.2.24LH2 | D.2.24LO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下图是将SO2转化为重要的化工原料H2SO4的原理示意图,下列说法不正确的是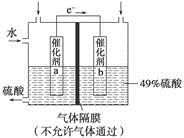
| A.该装置将化学能转化为电能 |
| B.催化剂b表面O2发生还原反应,其附近酸性增强 |
| C.催化剂a表面的反应是SO2+2H2O-2e-===SO42-+4H+ |
| D.若得到的硫酸浓度仍为49%,则理论上参加反应的SO2与加入的H2O的质量比为8∶15 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列叙述正确的是
| A.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极区产生的Cl2进入阳极区 |
| B.电解精炼铜时,反应开始一段时间内阳极溶解铜的质量比阴极析出铜的质量大 |
| C.海轮外壳上镶入锌块,可减缓船体的腐蚀 |
| D.在铁片上镀铜时,若铁片增重3.2g,则电路中通过的电子的物质的量为0.05mol |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某合作学习小组的同学利用下列氧化还原反应设计原电池:2KMnO4+10FeSO4+8H2SO4==2MnSO4+5Fe2(SO4)3+K2SO4+8H2O盐桥中装有饱和K2SO4溶液,下列叙述中正确的是
| A.乙烧杯中发生还原反应 |
| B.甲烧杯中溶液的pH逐渐减小 |
| C.电池工作时,盐桥中的SO42-移向甲烧杯 |
| D.外电路的电流方向是从a到b |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com