
【题目】下列常见物质的俗名与化学式对应正确的是( )
A.芒硝﹣BaSO4B.石英﹣Na2SiO3
C.苏打﹣Na2CO3D.冰晶石﹣Al2O3
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】I.某农民偶然发现一头小母牛食用腐败草料后,血液不会凝固。化学家由此得到启发,从腐败草料中提取出结构简式为下图所示的双香豆素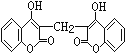 。下列关于双香豆素的推论中正确的是______
。下列关于双香豆素的推论中正确的是______
A.分子式为C19H12O6
B.能使FeCl3溶液发生显色反应
C.1mol 该物质最多可与10mol H2发生加成反应
D.它可由化合物  和甲醛(HCHO)在一定条件下反应制得
和甲醛(HCHO)在一定条件下反应制得
II.丁苯酞是我国自主研发的一类用于治疗急性缺血性脑卒的新药。合成丁苯酞(J)的一种路线如图所示:
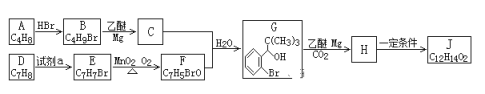
已知:①A的核磁共振氢谱有两组峰,
② 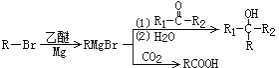
(1)A的名称是_________________;
(2)D生成E的反应类型为________________,试剂a是_____________;
(3)一定条件下,B可以发生化学反应生成A,则B生成A的化学方程式_______;
(4)H在一定条件下还能生成高分子化合物K,H生成K的化学方程式为________;
(5)M组成比F多1个CH2,M的分子式为C8H7BrO,M的同分异构体中,同时满足下列条件的同分异构体共有__________种。
①能发生银镜反应; ②含有苯环; ③不含甲基。
(6)利用题中信息写出以乙醛和苯为原料,合成![]() 的路线流程图______(其它试剂自选)。
的路线流程图______(其它试剂自选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于中和热测定实验的下列说法不正确的是
A. 烧杯间填满碎泡沫塑料是减少实验过程中的热量损失
B. 使用环形玻璃搅拌棒既可以搅拌又避免损坏温度计
C. 向盛装酸的烧杯中加碱时要小心缓慢
D. 测酸后的温度计要用水清洗后再测碱的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探索工业中含有铝、铁、铜的合金废料的再利用,某同学设计了如下回收方案:
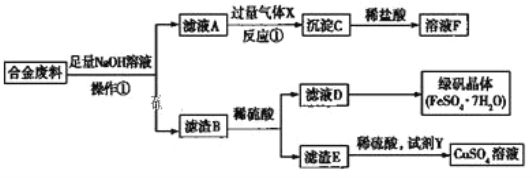
![]() 操作
操作![]() 的名称是___________,滤渣B含有_______________________ (填化学式)。
的名称是___________,滤渣B含有_______________________ (填化学式)。
![]() 合金废料与NaOH溶液反应的化学方程式:____________________________________;
合金废料与NaOH溶液反应的化学方程式:____________________________________;
![]() 反应
反应![]() 的离子方程式是___________________________________;
的离子方程式是___________________________________;
![]() 若要从滤液D中得到绿矾晶体,必须进行的实验操作是_____________、冷却结晶、过滤、洗涤、干燥,在这一系列操作中没有用到的仪器有_________________(填序号)。
若要从滤液D中得到绿矾晶体,必须进行的实验操作是_____________、冷却结晶、过滤、洗涤、干燥,在这一系列操作中没有用到的仪器有_________________(填序号)。
A.漏斗![]() 坩埚
坩埚![]() 烧杯
烧杯![]() 玻璃棒
玻璃棒
![]() 试剂Y应该是一种____________(填“氧化剂”或“还原剂”),它不可能是______(填序号)。
试剂Y应该是一种____________(填“氧化剂”或“还原剂”),它不可能是______(填序号)。
A.H2O2 B.H2 C.O2 D.Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质间的每步转化只需通过一步反应就能实现的是
A. S→SO3→H2SO4→Na2SO3 B. Al→Al (OH)3→Al2O3→Na[Al(OH)4]
C. Na→Na2O2→Na2CO3→NaOH D. Si→SiO2→H2SiO3→Na2SiO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能在下列溶液中大量共存的离子组是( )
A.含有大量Al3+的溶液:Na+、SO42﹣、Cl﹣
B.能使酚酞变红的溶液:Na+、Ca2+、CO32﹣
C.含有大量Fe3+的溶液:OH﹣、Mg2+、Cl﹣
D.含有大量HCO3﹣的溶液:H+、SO42﹣、Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构为 , ,下列有关说法正确的是
, ,下列有关说法正确的是
A.1 mol该物质与足量淮溴水反应,最多消耗2 molBr2
B.1mol该物质最多能与2mol NaOH反应
C.l mol该物质晟多能与3 mol H2加成
D.该物质的核磁共振氢谱共有6个吸收峰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2·8H2O)是一种在水产养殖中广泛使用的供氧剂。水中溶解氧的测定方法如下:向一定量水样中加入适量MnSO4和碱性KI溶液,生成MnO(OH)2沉淀,密封静置,加入适量稀H2SO4,待MnO(OH)2与I-完全反应生成Mn2+和I2后,以淀粉作指示剂,用Na2S2O3标准溶液滴定至终点,测定过程中物质的转化关系如下:
O2![]() MnO(OH)2
MnO(OH)2![]() I2
I2![]() S4O
S4O![]()
(1)写出O2将Mn2+氧化成MnO(OH)2的离子方程式:____________________________。
(2)取加过一定量CaO2·8H2O的池塘水样100.00 mL,按上述方法测定水样的溶解氧量,消耗0.010 00 mol·L-1Na2S2O3标准溶液13.50 mL。计算该水样中的溶解氧为___________ mg·L-1.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以软锰矿粉(主要含有MnO2,还含有少量的Fe2O3、Al2O3等杂质)为原料制备高纯MnO2的流程如下图所示:

已知:①常温下,Ksp[Fe(OH)3]=8.0×10-38,Ksp [Al(OH)3]=4.0×10-34。
②常温下,氢氧化物沉淀的条件:Al3+、Fe3+完全沉淀的pH分别为4.6、3.4;Mn2+开始沉淀的pH为8.1。
③常温下,当溶液中金属离子物质的量浓度小于或等于1×10-5mol·L-l时,可视为该金属离子已被沉淀完全。
(1) “酸浸”时加入一定量的硫酸,硫酸不能过多或过少。“硫酸”过多造成氨的损失;硫酸过少时,“酸浸”时会有红褐色渣出现,原因是________________________。
(2)加入氨水应调节pH的范围为__________________,当Fe3+恰好沉淀完全时,c(Al3+)=_____________mol·L-l。
(3)“过滤”所得滤渣为MnCO3,滤液中溶质的主要成分是____________(填化学式),写出其阳离子的电子式:_______________________________。
(4)加入碳酸氢铵产生沉淀的过程称为“沉锰”。
①“沉锰”过程中放出CO2,反应的离子方程式为_______________________________。
②“沉锰”过程中沉锰速率与温度的关系如图所示。当温度高于60℃时,沉锰速率随着温度升高而减慢的原因可能是________________________________________________。

(5)工业上采用间接氧化还原滴定法测定MnO2纯度,其操作过程如下:准确称量0.9200g该样品,与足量酸性KI溶液充分反应后,配制成100mL溶液。取其中20.00mL,恰好与25.00mL 0.0800mol·L-1 Na2S2O3溶液反应(I2+2S2O32-=2I-+S4O62-)。计算可得该样品纯度为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com