
| 溶质 | NaF | NaClO | Na2CO3 |
| pH | 7.5 | 9.7 | 11.6 |
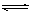 HClO + OHˉ的平衡常数K≈10ˉ7.6
HClO + OHˉ的平衡常数K≈10ˉ7.6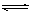 HClO + OHˉ,水解的平衡常数表为;
HClO + OHˉ,水解的平衡常数表为;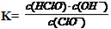 从上表可知常温下浓度为0.1 mol·L-1 NaClO溶液的pH=9.7,则pOH=4.3,c(OHˉ) = 10-4.3,所以,
从上表可知常温下浓度为0.1 mol·L-1 NaClO溶液的pH=9.7,则pOH=4.3,c(OHˉ) = 10-4.3,所以,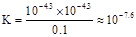 ,正确;D、向NaClO 溶液中通HF气体至恰好完全反应时,此时NaClO + HF =" NaF" + HClO,溶液中生成等物质的量的NaF和HClO,由于HClO为弱酸,不完全电离,存在着电离平衡:HClO
,正确;D、向NaClO 溶液中通HF气体至恰好完全反应时,此时NaClO + HF =" NaF" + HClO,溶液中生成等物质的量的NaF和HClO,由于HClO为弱酸,不完全电离,存在着电离平衡:HClO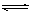 H+ + ClOˉ,同时,溶液中也还存在着NaF的水解平衡,但是终究水解程度是很微弱的,所以溶液中应该是c(Na+)>c(Fˉ) >c(HClO)>c(H+>c(OHˉ),故D不正确。
H+ + ClOˉ,同时,溶液中也还存在着NaF的水解平衡,但是终究水解程度是很微弱的,所以溶液中应该是c(Na+)>c(Fˉ) >c(HClO)>c(H+>c(OHˉ),故D不正确。

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:单选题
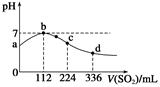
| A.原H2S溶液的物质的量浓度为0.05 mol·L-1 |
| B.氢硫酸的酸性比亚硫酸的酸性强 |
| C.b点水的电离程度比c点水的电离程度大 |
| D.a点对应溶液的导电性比d点强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.混合溶液可能显示酸性、碱性或中性 |
| B.混合溶液中一定存在c(NH4+)+c(H+)=c(Cl-)+c(OH-) |
| C.若a>b,则混合溶液中c(C1-)=c(NH4+)+c(NH3·H2O) |
D.若混合溶液显中性;则NH3·H2O的电离平衡常数为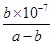 mol·L-1 mol·L-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.c(H+)>c(F-) | B.c(H+)>c(HF) |
| C.c(OH-)<c(HF) | D.c(HF)>c(F-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.常温下,由0.1 mol·L-1一元碱BOH溶液的pH=10,可推知BOH溶液存在:BOH B++OH- B++OH- |
| B.常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Cl-)>c(NH4+)>c(H+)=c(OH-) |
| C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 |
| D.将pH=4的盐酸稀释后,溶液中所有离子的浓度均降低 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
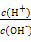 =1×10-8,下列叙述不正确的是( )
=1×10-8,下列叙述不正确的是( )| A.该溶液中氢离子的浓度:c(H+)=1×10-11 mol/L |
B.0.1 mol/L氨水溶液与0.1 mol/L HCl溶液等体积混合后所得溶液中:c(N )+c(H+)=c(Cl-)+c(OH-) )+c(H+)=c(Cl-)+c(OH-) |
C.0.1 mol/L的氨水溶液与0.05 mol/L H2SO4溶液等体积混合后所得溶液中:c(N )+c(NH3)+c(NH3·H2O)=2c(S )+c(NH3)+c(NH3·H2O)=2c(S ) ) |
D.浓度均为0.1 mol/L的NH3·H2O和NH4Cl溶液等体积混合后,若溶液呈碱性,则c(N )>c(NH3·H2O)>c(Cl-)>c(OH-)>c(H+) )>c(NH3·H2O)>c(Cl-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com