分析:(Ⅰ)(1)若A、D、F为非金属单质,且A、D同主族,A、F同周期,则A为C,D为Si,F为O
2,B为SiO
2,反应①为C与二氧化硅的反应生成Si与CO;
(2)B、C、F都是气态单质,B有毒,则B为氯气,反应②需要放电条件才能发生,为氮气与氧气反应,③、④反应中都有水生成,可以推知C为N
2,F为O
2,E为NO,A为NH
3,反应①为置换反应,A、D相遇有白烟生成,可推知D为HCl;
(3)若A、D为短周期元素单质,且所含元素的原子序数A是D的2倍,则A原子序数是偶数,所含元素的原子最外层电子数D是A的2倍,A最外层电子数小于4且为偶数,D位于第二周期、A位于第三周期,则A是Mg、D是C元素;F是D相邻元素的最高氧化物的水化物,则F为HNO
3,B能和Mg反应生成碳单质,则B是CO
2,C是Mg
O,MgO和硝酸反应生成Mg(NO
3)
2和H
2O,Mg和硝酸反应生成Mg(NO
3)
2,则E是Mg(NO
3)
2;
(Ⅱ)③Y和Z两元素可以形成四核41个质子的负一价阴离子,有以下三种情况:(1)Y
2Z
2-、(2)YZ
3-、(3)Y
3Z
-,由于该负一价阴离子有41个质子,质子数是偶数,可排除情况(1),令Z的质子数为n,由②Z元素原子核内质子数比Y原子核内质子数少9个知,则Y的质子数为n+9,若情况(2):(n+9)+3n=41;解之得:n=8;则n+9=17,所以Z为O元素,Y为Cl元素,若情况(3):3(n+9)+n=41;解之得:n=3.5(不合题意,舍去),故Z为O元素,Y为Cl元素;
由①X
+和Y
-两种离子具有相同的电子层结构,二者核外电子数相等,X原子比Y原子多2个质子,故X为K元素;
④W元素原子最外电子层上的电子数占其电子总数的三分之二,最外层电子数不能超过8,结合核外电子排布规律,则W只能处于短周期,令最外层电子数为x,若处于第二周期,则
(2+x)=x,解得x=4,故为C元素,若处于第三周期,则
(10+x)=x,解得x=20,不符合题意,故W为C元素;
由W、Z两元素所形成的含22个电子的化合物A为CO
2;由X、Y、Z三元素按原子个数比为1:1:1形成的化合物B为KClO.
解答:
解:(Ⅰ)(1)若A、D、F为非金属单质,且A、D同主族,A、F同周期,则A为C,D为Si,F为O
2,B为SiO
2,反应①为C与二氧化硅的反应生成Si与CO,该反应为2C+SiO
2Si+2CO↑,
故答案为:O
2;2C+SiO
2Si+2CO↑;
(2)B、C、F都是气态单质,B有毒,则B为氯气,反应②需要放电条件才能发生,为氮气与氧气反应,③、④反应中都有水生成,可以推知C为N
2,F为O
2,E为NO,A为NH
3,反应①为置换反应,A、D相遇有白烟生成,可推知D为HCl,反应①的化学方程式为:2NH
3+Cl
2=N
2+6HCl,反应③的化学方程式是:4NH
3+5O
24NO+6H
2O,属于放热反应,
故答案为:2NH
3+Cl
2=N
2+6HCl;放热;
(3)若A、D为短周期元素单质,且所含元素的原子序数A是D的2倍,则A原子序数是偶数,所含元素的原子最外层电子数D是A的2倍,A最外层电子数小于4且为偶数,D位于第二周期、A位于第三周期,则A是Mg、D是C元素;F是D相邻元素的最高氧化物的水化物,则F为HNO
3,B能和Mg反应生成碳单质,则B是CO
2,C是Mg
O,MgO和硝酸反应生成Mg(NO
3)
2和H
2O,Mg和硝酸反应生成Mg(NO
3)
2,则E是Mg(NO
3)
2,则:
反应①是Mg在二氧化碳中燃烧生成氧化镁与碳,实验现象是:镁在二氧化碳中剧烈燃烧,生成白色粉末,并由黑色物质生成;反应④是在加热条件下,碳和浓硝酸发生氧化还原反应生成二氧化碳、二氧化氮和水,反应的化学方程式为C+4HNO
3(浓)
CO
2+4NO
2↑+2H
2O,
故答案为:镁在二氧化碳中剧烈燃烧,生成白色粉末,并由黑色物质生成;C+4HNO
3(浓)
CO
2+4NO
2↑+2H
2O;
(Ⅱ)③Y和Z两元素可以形成四核41个质子的负一价阴离子,有以下三种情况:(1)Y
2Z
2-、(2)YZ
3-、(3)Y
3Z
-,由于该负一价阴离子有41个质子,质子数是偶数,可排除情况(1),令Z的质子数为n,由②Z元素原子核内质子数比Y原子核内质子数少9个,则Y的质子数为n+9,若情况(2):(n+9)+3n=41;解之得:n=8;则n+9=17,所以Z为O元素,Y为Cl元素,若情况(3):3(n+9)+n=41;解之得:n=3.5(不合题意,舍去),故Z为O元素,Y为Cl元素;
由①X
+和Y
-两种离子具有相同的电子层结构,二者核外电子数相等,X原子比Y原子多2个质子,故X为K元素;
④W元素原子最外电子层上的电子数占其电子总数的三分之二,最外层电子数不能超过8,结合核外电子排布规律,则W只能处于短周期,令最外层电子数为x,若处于第二周期,则
(2+x)=x,解得x=4,故为C元素,若处于第三周期,则
(10+x)=x,解得x=20,不符合题意,故W为C元素;
由W、Z两元素所形成的含22个电子的化合物A为CO
2,结构式为O=C=O,由X、Y、Z三元素按原子个数比为1:1:1形成的化合物B为KClO,其电子式为
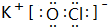
,
故答案为:Cl;O;O=C=O;
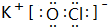
;

 ( I)、A、B、C、D、E、F六种物质的组成元素均为短周期元素,它们的转化关系如图.其中反应①为置换反应.
( I)、A、B、C、D、E、F六种物质的组成元素均为短周期元素,它们的转化关系如图.其中反应①为置换反应. ,
, ;
;


