
| A. | $\frac{2}{5}$ mol | B. | $\frac{11}{5}$ mol | C. | $\frac{1}{5}$ mol | D. | $\frac{1}{3}$ mol |
分析 反应中Cu的价态由+2→+1(还原),11molP元素中6mol化合价升高(氧化)、5mol化合价降低(还原),可见被氧化的6molP,是被Cu(+2)和另一部分P共同氧化的.再分析电子得失数目发现,6mol被氧化的P共失电子30mol,其中Cu(+2)得15mol,另一部分P得另15mol.即15molCuSO4所氧化的P为3mol,则1molCuSO4氧化P$\frac{1}{5}$mol.
解答 解:首先分析反应中各元素的化合价变化,Cu的价态由+2→+1(还原),11molP元素中6mol化合价升高(氧化)、5mol化合价降低(还原),可见被氧化的6molP,是被Cu(+2)和另一部分P共同氧化的.
由电子得失数目可知,6mol被氧化的P共失电子6mol×5=30mol,其中Cu(+2)得15mol,另一部分P得另15mol.即15molCuSO4所氧化的P为$\frac{15mol}{5}$=3mol,则1molCuSO4氧化P$\frac{1}{5}$mol.
故选C.
点评 本题考查氧化还原反应基本概念与计算,难度中等,关键根据化合价判断氧化剂与还原剂,可以直接利用Cu(+2)得电子等于CuSO4氧化的磷得电子数守恒计算,更为简单.


 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 只有①②③ | B. | 只有①② | C. | 只有②③ | D. | 只有①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
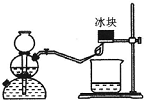 (1)下面所列的是中学化学实验室中几种常见的仪器:容量瓶、酸式滴定管、碱式滴定管、温度计、量筒、托盘天平、普通漏斗、玻璃棒、烧杯.
(1)下面所列的是中学化学实验室中几种常见的仪器:容量瓶、酸式滴定管、碱式滴定管、温度计、量筒、托盘天平、普通漏斗、玻璃棒、烧杯.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 转移容易后未洗涤烧杯和玻璃棒就直接定容 | |
| B. | 称氢氧化钠固体时直接放在称量纸上称 | |
| C. | 在容量瓶中进行定容时俯视刻度线 | |
| D. | 定容后把容量瓶倒转摇匀,发现液面低于刻度,再补充几滴水至刻度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将溶质物质的量之比为 2:7 的三氯化铝溶液和氢氧化钡溶液混合:2Al3++7OH-═Al(OH)3↓+AlO2-+2H2O | |
| B. | 澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| C. | 向硫酸氢钠溶液中滴加 Ba(OH)2 至中性:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| D. | 敞开体系,向FeCl2 溶液滴加NaOH 溶液:4Fe2++8OH-+O2+2H2O═4Fe(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 )分子中有5n个σ键
)分子中有5n个σ键| 化学键 | Si-Si | O═O | Si-O |
| 键能(kJ•mol-1) | a | b | c |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
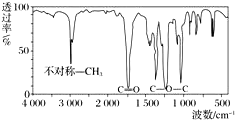 取8.8g有机物X,完全燃烧后只生成7.2g水和 8.96L CO2(标准状况),已知该有机物的蒸气对氢气的相对密度为44,其红外光谱图如图.关于X的说法错误的是( )
取8.8g有机物X,完全燃烧后只生成7.2g水和 8.96L CO2(标准状况),已知该有机物的蒸气对氢气的相对密度为44,其红外光谱图如图.关于X的说法错误的是( )| A. | 其化学式为C4H8O2 | |
| B. | 其满足右侧图象的酯有3种 | |
| C. | 鉴定该有机物的结构可用红外光谱或核磁共振氢谱 | |
| D. | 若结构为CH3COOCH2CH3,其核磁共振氢谱中有3个峰 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加水稀释时溶液中各离子浓度均减小 | |
| B. | 加强酸弱酸强碱弱碱均抑制盐类的水解 | |
| C. | 正盐水溶液的pH均为7 | |
| D. | 酸式盐的pH均小于7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com