
分析 ①无机非金属材是以某些元素的氧化物、碳化物、氮化物、卤素化合物、硼化物以及硅酸盐、铝酸盐、磷酸盐、硼酸盐等物质组成的材料,一般可认为是有机高分子材料和金属材料以外的所有材料的统称;
②根据水泥和玻璃的原料来分析;
③a.外面包上一层塑料层可减少与空气的接触;
b.镀上一层金属铬可以隔绝空气;
c.原电池能加快化学反应速率.
解答 解:①a.氮化硅陶瓷由N和Si两种非金属元素构成,故属于无机非金属材料,故a正确;
b.聚氯乙烯塑料是有机材料,故b错误;
c.钢筋是金属,故c错误;
故选a;
②生产玻璃的原料是纯碱、石灰石和石英,高温下,碳酸钠、碳酸钙和二氧化硅反应分别生成硅酸钠、硅酸钙;生产水泥以黏土和石灰石为主要原料,经研磨、混合后在水泥回转窑中煅烧,再加入适量石膏,并研成细粉就得到普通水泥;所以在玻璃工业、水泥工业中都用到的原料是石灰石,故选c;
③a.外面包上一层塑料层可减少与空气中氧气的接触,故a正确;
b.镀上一层金属铬可以隔绝空气,使金属不受腐蚀,故b正确;
c.原电池能加快化学反应速率,铁铜海水构成原电池,加快铁的腐蚀,故c错误.
故选c.
点评 本题考查合金的性质与金属腐蚀的防护等,题目难度不大,注意形成电解池和原电池能加快化学反应速率.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:解答题
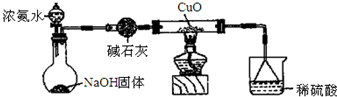
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | B. | CH2=CH2+HCl$\stackrel{催化剂}{→}$CH3CH2Cl | ||
| C. | 2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O | D. | 2C6H6+15O2$\stackrel{点燃}{→}$12CO2+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
| 熔点/K | 993 | 1539 | 183 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热的纯碱溶液去除油污能力更强 | |
| B. | NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火器 | |
| C. | 保存FeSO4溶液时加入少量铁粉 | |
| D. | 把AlCl3溶液加热蒸干灼烧至质量不再变化得到Al2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com