
| A、②④⑤ | B、①②④ |
| C、③⑤ | D、全部正确 |


科目:高中化学 来源: 题型:
| A、原子半径:Cl>S>O |
| B、还原性:Na>Mg>Al |
| C、稳定性:HF>HCl>HBr |
| D、酸性:HClO4>H2SO4>H3PO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有②③ | B、只有③④ |
| C、只有①③ | D、只有①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 与NaOH的醇溶液共热制备CH3-CH═CH2
与NaOH的醇溶液共热制备CH3-CH═CH2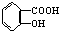 与适量NaOH溶液反应制备
与适量NaOH溶液反应制备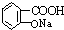
| A、都不正确 | B、只有①③正确 |
| C、只有②④正确 | D、都正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v(A)=0.5mol/(L?s) |
| B、v(B)=0.3 mol/(L?s) |
| C、v(C)=0.8 mol/(L?s) |
| D、v(D)=1 mol/(L?s) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、10种 | B、15种 |
| C、18种 | D、24种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 一种从植物中提取的天然化合物αdamascone可用于制作“香水”,其结构如图所示,下列有关该化合物的说法不正确的是( )
一种从植物中提取的天然化合物αdamascone可用于制作“香水”,其结构如图所示,下列有关该化合物的说法不正确的是( )| A、分子式为C14H20O |
| B、该化合物可发生聚合反应 |
| C、1mol该化合物完全燃烧消耗17.5mol O2 |
| D、1mol该化合物能与2 mol Br2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com