
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2015-2016学年江苏泰州中学高二上学业水平测试化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.22.4L氢气中含有的氢分子数目为NA
B.0.5molNa2CO3中含有的Na+数目为0.5NA
C.常温常压下,14g氦气含有的原子数目为NA
D.0.5moll/LFe2(SO4)3溶液中,SO42-的数目为1.5NA
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏中卫一中高一上第三次月考化学试卷(解析版) 题型:选择题
某溶液中含有Ba2+、Cu2+、Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离,其流程如右图所示。下列说法正确的是
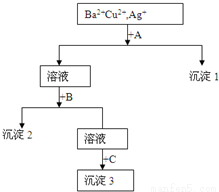
A.试剂A为Na2SO4溶液
B.生成沉淀1的离子方程式为:Cu2++2OH-=Cu(OH)2↓
C.沉淀3的化学式可能是BaSO4
D.生成沉淀2的离子方程式为:Ag++Cl-=AgCl
查看答案和解析>>
科目:高中化学 来源:2015-2016学年重庆市高二上期中测试化学试卷(解析版) 题型:选择题
(原创)下列说法不正确的是( )
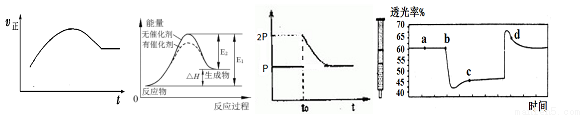
甲 乙 丙 丁
A.绝热恒容密闭容器中通入A和B,发生反应:2A (g)+B (g)  2C(g),图甲为其正反应速率随时间变化的示意图,则该反应为放热反应。
2C(g),图甲为其正反应速率随时间变化的示意图,则该反应为放热反应。
B.催化剂能降低反应的活化能,提高活化分子的百分含量,从而加快化学反应速率。图乙显示的是催化反应与无催化反应过程中的能量关系。
C.将BaO2放入密闭真空容器中,反应2BaO2(s) 2BaO(s)+O2(g)达到平衡时体系压强为P,保持温度不变,t0时刻将容器体积缩小为原来的1/2,体系重新达到平衡,体系压强变化如图丙所示。
2BaO(s)+O2(g)达到平衡时体系压强为P,保持温度不变,t0时刻将容器体积缩小为原来的1/2,体系重新达到平衡,体系压强变化如图丙所示。
D.将一定量的NO2充入针筒中后封口,发生反应2NO2 (g) N2O4(g),图丁[表示在拉伸和压缩针筒活塞的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。则c点与a点相比,c(NO2)增大,c(N2O4)增大。
N2O4(g),图丁[表示在拉伸和压缩针筒活塞的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。则c点与a点相比,c(NO2)增大,c(N2O4)增大。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年重庆市高一上期中测试化学试卷(解析版) 题型:选择题
下列各组离子,能在指定溶液中大量共存的是
A.无色溶液中:Ba2+、HCO3﹣、NO3﹣、K+
B.能使紫色石蕊试剂变红的溶液中:NH4+、NO3﹣、CO32﹣、Na+
C.使酚酞试液变红的溶液:Na+、Ca2+、NO3-、Cl-
D.有SO42-存在的溶液中:K+、Ba2+、Ag+、NO3﹣
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一上第三次月考化学试卷(解析版) 题型:填空题
取一定质量NaHCO3和Na2O2的固体混合物放入一密闭容器中加热至250℃,充分反应后排出所有气体。将反应后的固体分成相同的两份,将其中一份投入到足量的BaCl2溶液中,最后可得到3.94g沉淀.另一份溶于适量的水,无气体放出,再向水溶液中缓慢逐滴加入某物质的量浓度的盐酸,产生气体与所加盐酸体积之间的关系如下图所示.试回答下列问题:
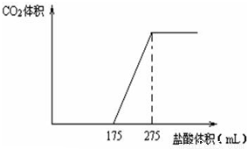
(1)反应后的固体的成分(填化学式)__________________;
(2)加入盐酸后总共产生的气体在标准状况下的体积为__________________;
(3)盐酸中HCl的物质的量浓度__________________;
(4)原固体混合物中m(NaHCO3)= ________、m(Na2O2)= ___________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北邢台一中高二上学期期中测试化学试卷(解析版) 题型:选择题
向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。下列对此现象说法不正确的是( )
A.反应前后溶液中Cu2+的浓度不同
B.在[Cu(NH3)4]2+离子中,Cu2+提供空轨道,NH3 给出孤对电子
C.向反应后的溶液加入乙醇,溶液没有发生变化
D.沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4]2+
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高一上12月月考化学试卷(解析版) 题型:实验题
某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。
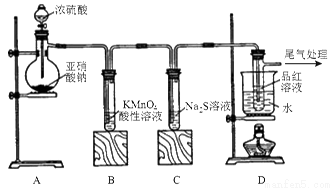
请回答下列问题:
(1)装置A中盛放浓硫酸的仪器名称是________;
(2)实验过程中,装置B中发生的现象是________,这个现象分别说明SO2具有的性质是________;
(3)装置C中Na2S溶液在空气中不易保存,时间长了会变浑浊,原因是(用离子方程式表示)____;
(4)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象_________________;
(5)如果把分液漏斗中的浓硫酸换成浓HNO3,对此实验是否有影响________(填“是”或“否”)。请说明你的理由___________________;
(6)工业上用黄铜矿(CuFeS2)冶炼铜,副产品中也有SO2,冶炼铜的反应为:8CuFeSO2+2IO2 8Cu+4FeO+2Fe2O3+16SO2若CuFeS2中 Fe 的化合价为+2,反应中被还原的元素是________(填元素符号),当生成0.8mol铜时,此反应转移的电子数目是________。
8Cu+4FeO+2Fe2O3+16SO2若CuFeS2中 Fe 的化合价为+2,反应中被还原的元素是________(填元素符号),当生成0.8mol铜时,此反应转移的电子数目是________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年西藏日喀则中学高二上12月月考化学试卷(解析版) 题型:填空题
常温下,有pH=12的NaOH溶液100mL,欲使它的pH为11。
(1)如果加入蒸馏水,就加入_____mL(忽略密度差别,下同)
(2)如果加入pH=10的NaOH溶液,应加入_______mL;
(3)如果加入0.008mol/L HCl溶液,应加入_______mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com