
 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案科目:高中化学 来源:2016-2017学年安徽省高二上期中化学卷(解析版) 题型:选择题
下列说法正确的是
A.强酸跟强碱的反应热一定是中和热
B.500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g) 2NH3(g) ΔH=-38.6kJ/mol
2NH3(g) ΔH=-38.6kJ/mol
C.吸热反应的发生都需要加热,放热反应在常温下一定容易发生
D.表示中和热的离子方程式为H+(aq)+OH-(aq) H2O(l) ΔH=-57.3kJ/mol
H2O(l) ΔH=-57.3kJ/mol
查看答案和解析>>
科目:高中化学 来源:2017届甘肃省高三上月考三化学试卷(解析版) 题型:选择题
标准状况下,将体积为V L的圆底烧瓶中充满氨气,倒扣在含有足量水的水槽中(如图所示),实验完毕后立即将烧瓶从水槽中取出,所得溶液的密度为ρg·cm﹣3。下列说法错误的是
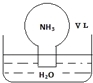
A.水最终会充满整个烧瓶
B.所得溶液的物质的量浓度为 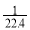 mol·L﹣1
mol·L﹣1
C.所得溶液的质量分数为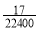 ρ
ρ
D.所得溶液中,n(NH3·H2O)+n(NH4+)=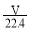 mol
mol
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江大庆铁人中学高一上期中化学卷(解析版) 题型:实验题
实验室需要配制0.5mol?L-1的烧碱溶液480 mL,根据溶液配制的过程,回答下列问题:
(1)配制该溶液时,使用的玻璃仪器是烧杯、玻璃棒、量筒、 、 ,容量瓶在使用前必须进行的一步操作是 。
(2)配制时,一般可分为以下几个步骤:①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却,其正确的操作顺序为 ,称量时应称取烧碱的质量为 。
(3)在配制过程中,下列操作对所配溶液浓度的影响是(填偏高、偏低或无影响)
①配制前,容量瓶内有水_________
②溶液未冷却便定容__________
③定容时仰视刻度线__________
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江大庆铁人中学高一上期中化学卷(解析版) 题型:选择题
实验室里需要配制480mL 0.1mol·L-1的硫酸铜溶液,以下操作正确的是 ( )
A. 称取7.68g硫酸铜,加入 500mL水
B. 称取12.0g胆矾配成500mL溶液
C. 称取8.0g硫酸铜,加入500mL水
D. 称取12.5g胆矾配成500mL溶液
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高一上11月月考化学卷(解析版) 题型:填空题
高锰酸钾在不同的条件下发生的反应如下:
MnO4-+5e-+8H+═Mn2++4H2O ①
MnO4-+3e-+2H2O═MnO2↓+4OH- ②
MnO4-+e-═MnO42-(溶液呈绿色) ③
(1)从上述三个半反应中可以看出高锰酸根离子被还原的产物受溶液的_________影响。
(2)将SO2通入高锰酸钾溶液中,发生还原反应的离子反应过程为_________→_________。
(3)将PbO2投入到酸性MnSO4溶液中搅拌,溶液变为紫红色.下列说法正确的是_________(填字母)
A.氧化性:PbO2>KMnO4 B.Mn2+被还原成MnO4- c.该反应可以用盐酸酸化
(4)将高锰酸钾逐滴加入到硫化钾溶液中发生如下反应,其中K2SO4和S的物质的量比为3:2。
完成下列化学方程式:
①_______KMnO4+_______ K2S+_______→ _______K2MnO4+ ______ K2SO4+_______ S↓+ ______
②若生成6.4g单质硫,反应过程中转移的电子的物质的量为 _________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高一上11月月考化学卷(解析版) 题型:选择题
相等物质的量的KClO3分别发生下述反应:①有MnO2催化剂存在时,受热分解得到氧气; ②若不使用催化剂,加热至470 ℃左右,得到KClO4(高氯酸钾)和KCl。下列关于①和②的说法不正确的是
A.都是氧化还原反应 B.发生还原反应的元素相同
C.发生氧化反应的元素不同 D.生成KCl的物质的量相同
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高一上11月月考化学卷(解析版) 题型:选择题
阿伏伽德罗常数约为6.02×1023mol-1,下列叙述中正确的是
①1.01×105Pa、25℃时,2.24LCl2中含有的原子数为0.2NA
②0.1L3mol﹒L-1NH4NO3溶液中含有的N原子数目为0.3NA
③5.6g铁粉和足量的硫酸铜溶液反应生成的铜原子数为NA
④常温常压下,46gNO2和N2O4的混合物中含有的原子数为3NA
⑤1molNH3所含有的电子数为17NA
⑥1mol/LNaCl溶液中所含的Na+数为NA
⑦常温常压下,28g氮气所含的原子数为2NA
⑧标准状况下,22.4L水所含有的分子数目为NA
A.①④⑤ B.②③⑥⑦ C.④⑦ D.⑤⑥
查看答案和解析>>
科目:高中化学 来源:2016-2017学年西藏拉萨中学高二上月考三化学卷(解析版) 题型:选择题
下列各溶液中,微粒的物质的量浓度关系表述正确的是:
A.0.1 mol·L-1的(NH4)2SO4溶液中:c(SO42-) >c(NH4+) > c(H+) > c(OH-)
B.在25 ℃ 100 mL NH4Cl溶液中:c(Cl-) = c(NH4+) + c(NH3·H2O)
C.将0.2 mol·L-1NaA溶液和0.1 mol·L-1盐酸等体积混合所得碱性溶液中:c(Na+) + c(H+) = c(A-) + c(Cl-)
D.0.1 mol·L-1的NaHCO3溶液中:c(Na+) = c(HCO3-) + c(H2CO3) + 2c(CO32-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com